��Ŀ����
����Ŀ���ҹ����Ѵ�����ֲ��㷺�������ḻ��������������Ҫ��Դ�����а������ѡ��������ȶ��ֳɷֻ����кܸߵ����ü�ֵ����β���ǹ�ҵ��ȡ�ѵ���Ҫ��Դ
I.���Ѵ������β��(��Ҫ�ɷ�ΪFeTiO3������������FeO��Al2O3��SiO2������)��ѡ���õ��Ѿ����һϵ�з�Ӧ�Ƶ�TiO2:

(1)�������ƾ���β���Ŀ����_________________________________��
(2)д���Ѿ�����FeTiO3��80%������Һ��Ӧ�Ļ�ѧ����ʽ:___________________��
II.��TiO2Ϊԭ���Ʊ������ѣ���������:TiO2��TiCl4��Ti
(3)��֪��Ӧ:TiO2(s)ʮ2Cl2(g)=TiCl4(l)ʮO2(g) ��H=ʮ151kJ/mol����������TiO2��Cl2ֱ�ӷ�Ӧ(���Ȼ���Ӧ)����ȡTiCl4�Խ���ԭ��:___________________________________��
(4)�����Ȼ���Ӧ��ϵ�м���̼��ʹ�ø÷�Ӧ�ڸ�����������˳���Ƶ�TiCl4���ӻ�ѧƽ��ĽǶȽ�����ԭ��___________________________________________��
(5)��֪̼��ȼ����394kJ/mol����д��TiO2��Cl2��C��Ӧ��ȡTiCl4���Ȼ�ѧ����ʽ_____________��
III.��TiO2Ϊԭ�Ͽ����Ʊ�Li4Ti5O12(һ������ӵ�صĵ缫����)����������:
![]()
(6)��ͬ�¶��£�TiO2��xH2O��˫��ˮ����ˮ��Ӧ�ﵽƽ������ʵ�������±���ʾ:
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2��xH2O��ת���� | 80% | 90% | 97% | 93% | 82% |
�ù��̵������¶�Ϊ_______________�������������ݣ�����TiO2��xH2O��ת�������¶ȱ仯��ԭ��:_______________________________________���÷�Ӧ�����ӷ���ʽΪ________________________��
���𰸡� ��ȥAl2O3��SiO2�ȿ����������Ʒ�Ӧ������ 2H2SO4ʮFeTiO3=TiOSO4ʮFeSO4ʮ2H2O ��H>0����S<0�æ�G>0����Ӧ�ѷ��� ̼��������Ӧ���������������Ũ�ȣ�ƽ�������ƶ���ʹ�÷�Ӧ˳������ TiO2(s)ʮ2Cl2(g)ʮC(s)=TiCl4(s)ʮCO2(g) ��H=-243kJ/mol 40�� 30�浽40�棬���¶����ߣ�TiO2��xH2O��ת����fu����˵���÷�Ӧ�����ȷ�Ӧ;40�浽50�棬�¶����ߣ�TiO2��xH2O��ת���ʽ��ͣ���Ϊ˫��ˮ���ȶ��ֽ� 5TiO2��xH2O+4H2O2+2NH3��H2O==Ti5O152-+2NH4++(5x+5)H2O
��������(1)β�����Ҫ�ɷ�ΪFeTiO3������������FeO��Al2O3��SiO2�����ʣ�������Щ���ʵ����ʣ�FeTiO3��FeO������NaOH��Ӧ����Al2O3��SiO2����NaOH��Ӧ�����Լ���NaOH��ȥAl2O3��SiO2�����ʣ�
(2)�Ѿ�����FeTiO3�������Ƿ�Ӧ���������TiOSO4���ٸ��������غ��д����Ӧ�Ļ�ѧ����ʽΪ2H2SO4+FeTiO3==TiOSO4+FeSO4+2H2O��
(3)�����Ȼ�ѧ����ʽTiO2(s)ʮ2Cl2(g)=TiCl4(l)ʮO2(g) ��H= +151kJ/mol����֪��H>0����S<0��������G=��H-T��S>0����˷�Ӧ�����У��ʲ�����TiO2��Cl2ֱ�ӷ�Ӧ(���Ȼ���Ӧ)����ȡTiCl4��
(4)�����Ȼ���Ӧ��ϵ�м���̼ʱ���ڸ�������̼��������Ӧ����CO2���壬�������������Ũ�ȣ�ʹƽ�������ƶ�����Ӧ����˳��������ȥ��
(5)��֪̼��ȼ����394kJ/mol����C(s)+O2(g)=CO2(g) ��H=-394kJ/mol�� ��TiO2(s)ʮ2Cl2(g)=TiCl4(l)ʮO2(g) ��H=+151kJ/mol����ʽ��Ӽ���TiO2(s)+C(s)+2Cl2(g)= TiCl4(l) + CO2(g) ��H=��243kJ/mol��
(6)�ɱ������ݿ�֪����40��ʱ��TiO2��xH2O��ת����������Ըù��̵������¶�Ϊ40�棻�����������ݣ���30�浽40�棬���¶����ߣ�TiO2��xH2O��ת��������˵���÷�Ӧ�����ȷ�Ӧ����40�浽50�������¶����ߣ�TiO2��xH2O��ת���ʼ�С������Ϊ˫��ˮ���ȶ������ֽ⣻��ת����ϵ��֪TiO2��xH2O��H2O2��NH3��H2O�Ƿ�Ӧ�������Ϊ(NH4)2 Ti5O15�����ݻ��ϼ��������ɣ�TiԪ�ػ��ϼ۴�+4�����ߵ�+5.6�ۣ���H2O2����Ԫ�ػ��ϼ۽�������ˮ�����Է�Ӧ�����ӷ���ʽΪ5TiO2��xH2O+4H2O2+2NH3��H2O==Ti5O152-+ 2NH4+ + (5x+5)H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���±���A��B��C�����л�����й���Ϣ��
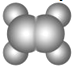
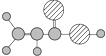
A | ����ʹ���������̼��Һ��ɫ���ڱ���ģ��Ϊ�� ������ˮ��һ�������·�Ӧ����C |
B | ����C��H��O����Ԫ����ɣ������ģ��Ϊ |
C | ����C��H��O����Ԫ����ɣ�������Na��Ӧ����������NaOH��Һ��Ӧ�� ������B��Ӧ������Է�������Ϊ88���� |
������Ϣ�ش��������⣺
��1��д��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ____________________________����Ӧ����Ϊ______________��
��2��A�����������ӳɷ�Ӧ����������D��д����������Ҫ����л���Ľṹ��ʽ��_______��
����D��Ϊͬϵ�� �ڷ�����̼ԭ��������4 �۷��������һ��֧��
��3����������B�й�˵����ȷ����_____ (�����) ��
����ɫ��ζҺ�� ���ж� ��������ˮ �ܾ������ԣ�����̼��Ʒ�Ӧ �ݹ�������-OH
��4��д����Ũ���������£�B��C��Ӧ�������Ļ�ѧ����ʽ________________________________��
��5�������Լ��У������ڼ���C���Ƿ���ˮ����______ (�����)��
��CuSO4��5H2O ����ˮ����ͭ ��Ũ���� �ܽ�����
����Ŀ��ij��ɫϡ��ҺX�У����ܺ����±����������е�ij���֣�
������ | CO32����SiO32����AlO2����Cl�� |
������ | Al3+��Fe3+��Mg2+��NH4+��Na+ |
��ȡ����Һ�����������м���ij�Լ�Y���������������ʵ�����n��������Լ������V���Ĺ�ϵ��ͼ��ʾ��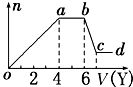
��1����Y�����ᣬ��oa��ת��Ϊ���������ӣ�ָ��Դ��X��Һ�ģ���ͬ���� �� ab�η�����Ӧ�������� �� bc�η�����Ӧ�����ӷ���ʽΪ ��
��2����Y��NaOH��Һ����X��һ�����е��������� �� �����ʵ���֮��Ϊ �� ab�η�Ӧ�����ӷ���ʽΪ ��
����Ŀ����ͼ�����÷�ͭм�������ʣ��Ʊ�����������ͭ���壩�Ĺ��� 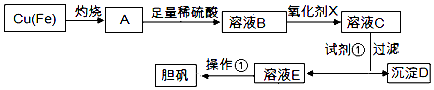
��֪��
��Һ�б����������� | Fe3+ | Fe2+ | Cu2+ |
��ȫ������������ij���ʱ����Һ��pH | ��3.7 | ��6.4 | ��4.4 |
��ش�
��1��������������������������X����������ĸ����
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
��2�������Լ�����Ϊ�˵���pH���Լ��ٿ���ѡ�����ѧʽ����
��3�������ٵ������� ��
��4������D����������Եõ�FeCl3��Һ������FeCl3��Һ��������˵������ȷ���� ��
A.��FeCl3������Һ��μ����ˮ�У����������ȵõ����ɫҺ�壬��Һ���ܲ��������ЧӦ
B.��FeCl3��Һ�μ�NaOH��Һ�����ֺ��ɫ����
C.��FeCl3��Һ�μ�NaOH��Һ���������������գ��õ�Fe��OH��3����
D.��FeCl3��Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ
��5������D������������ۣ������Ƶ�FeCl2��Һ��ʵ���ұ���FeCl2��Һ���������������۷�ֹFeCl2��Һ���ʣ���ԭ�����������ӷ���ʽ��ʾ����
��6������̼�缫�������ͭ��Һ200mL��ͨ��5min����������0.64g���������Һ��pH=����Һ����仯���Բ��ƣ���