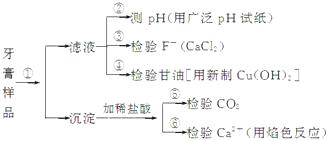
题目内容
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种.
阴离子 | CO32﹣、SiO32﹣、AlO2﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.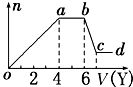
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 , ab段发生反应的离子是 , bc段发生反应的离子方程式为 .
(2)若Y是NaOH溶液,则X中一定含有的阳离子是 , 其物质的量之比为 , ab段反应的离子方程式为 .
【答案】
(1)AlO2﹣、SiO32﹣; CO32﹣; Al(OH)3+3H+=Al3++3H2O
(2)Al3+、Mg2+、NH4+;2:1:4; NH4++OH﹣═NH3?H2O
【解析】解:(1)某无色稀溶液X中,无色溶液中不会含有Fe3+,加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸中而后者不能,所以由图象知溶液中含有SiO32﹣、AlO2﹣;则oa段发生反应的离子为AlO2﹣、SiO32﹣;ab段发生的反应沉淀的量不变,所以ab段为盐酸与CO32﹣反应,bc段沉淀减少,则是Al(OH)3溶解于盐酸,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O.
故答案为:AlO2﹣、SiO32﹣;CO32﹣;Al(OH)3+3H+=Al3++3H2O;(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO32﹣、SiO32﹣、AlO2﹣,由于溶液一定要保持电中性,故溶液中一定含Cl﹣;当a﹣b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH﹣═NH3H2O,即溶液中含NH4+;当b﹣c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,即bc段的反应为:Al(OH)3+OH﹣═AlO2﹣+2H2O.
即则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl﹣;由于溶液中有Al3+、Mg2+,故oa段转化为沉淀的离子是Al3+、Mg2+,ab段是氢氧化钠和铵根离子反应生成气体,反应的离子方程式为NH4++OH﹣═NH3H2O;溶液中有Al3+、Mg2+,即沉淀中含Al(OH)3和Mg(OH)2,故bc段的反应为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
NH4+反应需要NaOH的体积是2V,由于Al(OH)3溶解时需要的NaOH的体积是V,则生成Al(OH)3需要的NaOH的体积是3V,而生成Mg(OH)2和Al(OH)3共消耗NaOH的体积为4V,则生成Mg(OH)2需要NaOH溶液的体积是V,则n(Al3+):n(Mg2+):n(NH4+)=2:1:4,
故答案为:Al3+、Mg2+、NH4+;2:1:4;NH4++OH﹣═NH3H2O.
(1)无色溶液中不会含有Fe3+,加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸中而后者不能,由图象知溶液中肯定含有AlO2﹣、SiO32﹣.
oa段发生反应的离子为AlO2﹣、SiO32﹣,ab段为CO32﹣,bc段则是Al(OH)3溶解;(2)当向溶液中加入NaOH时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是NH4+与OH﹣之间发生反应,因Mg2+、Al3+不能与CO32﹣、SiO32﹣、AlO2﹣共存,故此时溶液中阴离子只有Cl﹣.结合图象,溶解Al(OH)3、与NH4+作用、生成Al(OH)3消耗的NaOH体积比为1:2:3;由此可求出与Mg2+反应时消耗的NaOH体积与溶解Al(OH)3消耗NaOH 溶液一样多,故溶液中n(Al3+):n(Mg2+):n(NH4+)=2:1:4,最后就得到各种离子物质的量比.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SO2 |
B | CO2 | NaOH | NaCl | Na2CO3 |
C | HCl | NaOH | CaF2 | CH3COOH |
D | HNO3 | KOH | CaCO3 | CaO |
A. A B. B C. C D. D