题目内容
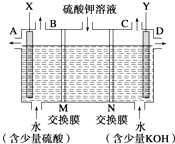
【题目】NOx在阳光的作用下会引起光化学烟雾,从而造成严重的大气污染。火力发电厂烟气中含有大量氮氧化物,必须对燃烧后的烟气进行处理,其原理如下(已知:燃烧系统排放烟气中的NOx,90%以上是NO):
![]()
请回答:
(1)NO2气体的颜色为______。
(2)下列物质可作试剂A的是______(填字母)。
a.O3 b.CO c.NH3 d.ClO2
(3)试剂B可使用Na2SO3溶液,该反应的化学方程式为______。
(4)NO2还可以用NaOH溶液吸收(原理:2NO2+2NaOH===NaNO2+NaNO3+H2O)。取一定量 NO2用过量的V1 mL c1 mol·L1NaOH溶液吸收完全,剩余NaOH用V2 mL c2 mol·L1 H2SO4溶液恰好中和,则被吸收的NO2物质的量是______。
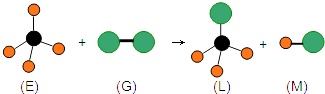
【答案】红棕色 a d 2NO2+4Na2SO3 ![]() N2+4Na2SO4 (c1 V1 - 2c2 V2) ×10-3 mol
N2+4Na2SO4 (c1 V1 - 2c2 V2) ×10-3 mol
【解析】
NO转化为NO2的过程中氮元素化合价升高,被氧化,则试剂A是氧化剂,NO2转化为氮气时氮元素化合价降低,被还原,则试剂B是还原剂,结合物质的性质分析判断。
(1)NO2气体为红棕色。
(2)NO转化为NO2的过程中氮元素化合价升高,失去电子,A具有强氧化性,因此物质可以是臭氧或ClO2,CO或氨气具有还原性,不能将NO转化为NO2,答案选ad;
(3)试剂B可使用Na2SO3溶液,与二氧化氮反应生成氮气和硫酸钠,根据电子得失守恒可知该反应的化学方程式为2NO2+4Na2SO3=N2+4Na2SO4。
(4)消耗硫酸的物质的量是0.001c2V2mol,则与硫酸反应的氢氧化钠是0.002c2V2mol,因此与NO2反应的氢氧化钠是(c1V1-2c2V2)×10-3mol,所以根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O可知被吸收的NO2物质的量是(c1V1-2c2V2)×10-3mol。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2等杂质)经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________。
II.以TiO2为原料制备金属钛,流程如下:TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
(5)己知碳的燃烧热394kJ/mol,请写出TiO2与Cl2、C反应制取TiCl4的热化学方程式_____________。
III.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
![]()
(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。