题目内容
【题目】下表是A、B、C三种有机物的有关信息:
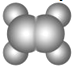
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
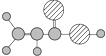
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为88的酯 |
请结合信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式____________________________,反应类型为______________。
(2)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(3)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(4)写出在浓硫酸作用下,B与C反应生成酯的化学方程式________________________________。
(5)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠
【答案】 CH2=CH2+Br2→CH2BrCH2 Br 加成反应 ![]() ③④ CH3OOH+HOCH2CH3
③④ CH3OOH+HOCH2CH3![]() CH3COOCH2CH3+H2O ②
CH3COOCH2CH3+H2O ②
【解析】分析:A能使能使溴的四氧化碳溶液褪色,根据比例模型可判断A是乙烯。A能与水在一定条件下反应生成C,C由C、H、O三种元素组成,且能与Na反应,但不能与NaOH溶液反应,因此C是乙醇。C能与B反应生成相对分子质量为88的酯,根据质量守恒定律可知说明B的相对分子质量是88+18-46=60,B由C、H、O三种元素组成,根据B的球棍模型可知B是乙酸,结合物质的结构与性质解答。
详解:根据以上分析可知A是乙烯,B是乙酸,C是乙醇。则
(1)乙烯含有碳碳双键,能与溴的四氯化碳溶液发生加成反应,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br。
(2)乙烯与氢气发生加成反应后生成物质D是乙烷,①与D互为同系物,说明属于烷烃;②分子中碳原子总数是4,是丁烷;③分子里带有一个支链,应该是异丁烷,结构简式为![]() ;
;
(3)①乙酸是强烈有刺激性气味的无色液体,①错误;②乙酸没有毒,②错误;③乙酸易溶于水,③正确;④乙酸含有羧基,具有酸性,酸性强于碳酸,能与碳酸钙反应,④正确;⑤乙酸的官能团是-COOH,⑤错误,答案选③④;
(4)在浓硫酸作用下,乙酸与乙醇发生酯化反应生成酯的化学方程式为CH3OOH+HOCH2CH3![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
(5)一般用无水硫酸铜检验水的存在,实验现象是变为蓝色;钠与乙醇和水均反应产生气体,不能检验乙醇中是否含有水。浓硫酸具有吸水性,但无明显实验现象,答案选②。

【题目】我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2等杂质)经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________。
II.以TiO2为原料制备金属钛,流程如下:TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
(5)己知碳的燃烧热394kJ/mol,请写出TiO2与Cl2、C反应制取TiCl4的热化学方程式_____________。
III.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
![]()
(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。