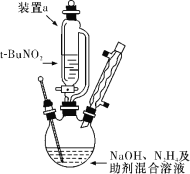
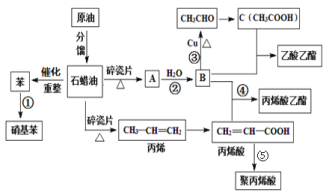
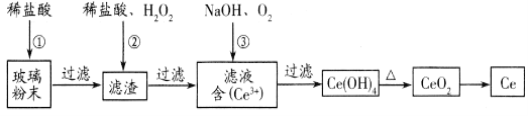
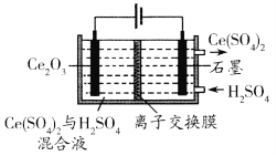
题目内容
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_____Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________________________。
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________,SO42-、CS2、CO32-键角由大到小的顺序是______________________
(4)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫也可以发生类似水的自身电离2SO2![]() SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
(5)分析并比较物质A: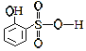 与B:
与B: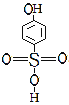 的沸点高低及其原因:__
的沸点高低及其原因:__
【答案】[Ar]3d104s2 大于 Zn核外电子排布为全满稳定结构,较难失电子 平面三角形 sp2 CS2>CO32->SO42- O N2 1:2 B>A,因为B可以形成分子间氢键
【解析】
(1)Zn是第30号元素,核外电子排布式为[Ar]3d104s2,故答案为:[Ar]3d104s2。
(2)由于Zn核外电子排布为全满稳定结构,较难失电子,所以Zn的第一电离能高于Cu的第一电离能,故答案为:大于;Zn核外电子排布为全满稳定结构,较难失电子。
(3)碳酸锌中的阴离子为CO32-,根据价层电子对互斥理论,其中心原子C的价电子对为3+![]() =3,所以空间构型为平面三角形,中心C为sp2杂化;对于SO42-,根据VSEPR理论,中心S原子的配位原子数为4,孤电子对数为=
=3,所以空间构型为平面三角形,中心C为sp2杂化;对于SO42-,根据VSEPR理论,中心S原子的配位原子数为4,孤电子对数为=![]() =0,则其价电子对数为4+0=4,根据杂化轨道理论,中心S原子为sp3杂化,键角为109°28′,对于CS2,根据VSEPR理论,中心C原子的配位原子数为2,孤电子对数为
=0,则其价电子对数为4+0=4,根据杂化轨道理论,中心S原子为sp3杂化,键角为109°28′,对于CS2,根据VSEPR理论,中心C原子的配位原子数为2,孤电子对数为![]() =0,则其价电子对数为2+0=2,根据杂化轨道理论,中心C原子为sp杂化,键角为180°,对于CO32-中心C原子为sp2杂化,键角为120°,因此键角大小为:CS2>CO32->SO42-,故答案为:平面三角形;sp2;CS2>CO32->SO42-。
=0,则其价电子对数为2+0=2,根据杂化轨道理论,中心C原子为sp杂化,键角为180°,对于CO32-中心C原子为sp2杂化,键角为120°,因此键角大小为:CS2>CO32->SO42-,故答案为:平面三角形;sp2;CS2>CO32->SO42-。
(4)非金属性越强,电负性越大,O、S为同一主族,非金属性逐渐减弱,所以非金属性:O>S;SO2+含有2个原子和10个价电子,因此与SO2+互为等电子体的单质分子是氮气,由于SO2+的结构与氮气相似,则σ键和兀键数目比为1:2,故答案为:O,N2,1:2。
(5)A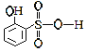 邻羟基苯磺酸能形成分子内氢键,B
邻羟基苯磺酸能形成分子内氢键,B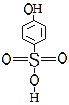 对羟基苯磺酸能形成分子间氢键,所以沸点B>A,故答案为:B>A,因为B可以形成分子间氢键。
对羟基苯磺酸能形成分子间氢键,所以沸点B>A,故答案为:B>A,因为B可以形成分子间氢键。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ、在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是_____。用NO表示从0~2 s内该反应的平均速率υ=_______。
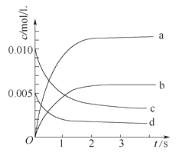
(2)能说明该反应已达到平衡状态的是_______。
a.υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内密度保持不变
(3)下列措施能使该反应的速率增大是_______。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂