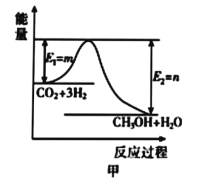
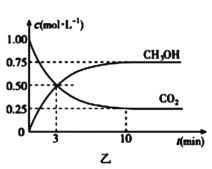
题目内容
【题目】Ⅰ、在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
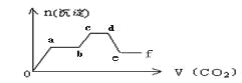
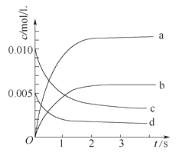
(1)下图中表示NO2的变化的曲线是_____。用NO表示从0~2 s内该反应的平均速率υ=_______。
(2)能说明该反应已达到平衡状态的是_______。
a.υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内密度保持不变
(3)下列措施能使该反应的速率增大是_______。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】b 0.003mol/(L·s) bc bcd
【解析】
(1)根据表格知,随着反应的进行,NO的物质的量减小,则NO2的物质的量逐渐增大,根据NO和NO2之间转化关系式计算平衡时NO2的物质的量,从而确定曲线;根据υ=![]() 计算NO的反应速率;
计算NO的反应速率;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(3)根据外界条件对反应速率的影响进行分析解答。
(1)根据表格知,随着反应的进行,NO的物质的量减小,则NO2的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.0200.007)mol=0.013mol,根据NO2和NO的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)=![]() =0.0065mol/L,则表示NO2的变化的曲线是b;0~2s时,υ (NO)=
=0.0065mol/L,则表示NO2的变化的曲线是b;0~2s时,υ (NO)= =0.003mol/(L·s);
=0.003mol/(L·s);
(2)a.当υ(NO2)=2υ(O2)时,没有指明反应速率的方向,不能判断反应是否达到平衡状态,故a不选;
b.该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,即容器内压强保持不变能说明反应达到平衡状态,故b选;
c.υ逆(NO):υ正(O2)=2:1时,该反应达到平衡状态,故c选;
d.根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以容器内密度保持不变不能说明反应是否达到平衡状态,故d不选;
故选bc;
(3)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,故b正确;
c.增大O2的浓度,反应速率增大,故c正确;
d.选择高效的催化剂,增大反应速率,故d正确;
故选bcd。

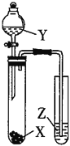
【题目】下列实验操作能达到实验目的的是
选项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z |
| ||
A | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
B | 石灰石 | 浓盐酸 | Na2SiO3溶液 | C元素非金属性大于Si元素 | |
C | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
D | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 | |
A.AB.BC.CD.D