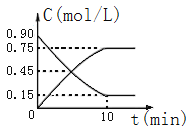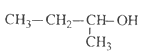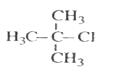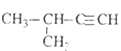题目内容
【题目】请根据要求填空:
(1)将0.10mol/L NH3H2O溶液稀释10倍,则稀释后的溶液中c(OH﹣)____原来的十分之一(填“大于”、“小于”或“等于”).
(2)实验测得0.10mol/L CH3COONH4溶液的pH=7,则c(CH3COO-)_____c(NH4+)(填写同上).
(3)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可以定量测定市售硫代硫酸钠(M=158)的纯度,现在称取7.900g硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用含有I2为 0.1000mol/L的碘水滴定,消耗碘水20.00mL,则:
①滴定应选择的指示剂是____________,滴定终点的现象是:____________________________
②对于该滴定实验的有关操作或误差分析正确的是(_______)
A.滴定前,应对滴定管、锥形瓶进行润洗操作
B.滴定过程中,标准液滴到锥形瓶外,会使所测结果偏大
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则所测得的纯度将会偏小
D.滴定前仰视读数而滴定结束时平视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度为______________________________
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀加入CaCl2溶液的最小浓度为______ mol/L。
【答案】大于 等于 淀粉溶液 溶液颜色由无色变成蓝色,且半分钟内不褪色 BD 80% 5.6×10-5
【解析】
(1)加水稀释,一水合氨的电离平衡向右移动,即电离被促进,电离出更多的氢氧根;
(2)根据电荷守恒c(OH﹣)+c(CH3COO﹣)= c(H+)+ c(NH4+),溶液的pH=7,即c(OH﹣)=c(H+),故c(CH3COO﹣)=c(NH4+);
(3)①淀粉遇到单质碘变蓝色;根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
②根据c(待测)=![]() 分析不当操作对相关物理量的影响,以此判断浓度的误差;
分析不当操作对相关物理量的影响,以此判断浓度的误差;
③求出硫代硫酸钠的质量,样品中硫代硫酸钠纯度=![]() ×100%;
×100%;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍。
(1)加水稀释,一水合氨的电离平衡向右移动,即电离被促进,电离出更多的氢氧根,故将0.10mol/L NH3H2O溶液稀释10倍,则稀释后的溶液中c(OH﹣)大于原来的十分之一,故答案为:大于。
(2)根据电荷守恒可以知道:c(OH﹣)+c(CH3COO﹣)= c(H+)+ c(NH4+),0.10mol/L CH3COONH4溶液的pH=7,即c(OH﹣)=c(H+),故有c(CH3COO﹣)=c(NH4+),故答案为:等于。
(3)①淀粉遇到单质碘变蓝色,滴定前可以选择淀粉做指示剂,滴定终点的现象为溶液颜色由无色变成蓝色,且半分钟内不褪色,故答案为:淀粉;溶液颜色由无色变成蓝色,且半分钟内不褪色。
②A.滴定前,对滴定管、锥形瓶进行润洗,待测液的物质的量偏大,造成V(标准)偏大,根据![]() 分析,c(待测)偏高,故A错误;
分析,c(待测)偏高,故A错误;
B.滴定过程中,标准液滴到锥形瓶外,造成V(标准)偏大,根据c(待测)=![]() 分析,c(待测)偏高,故B正确;
分析,c(待测)偏高,故B正确;
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析,c(待测)偏高,待测液的物质的量偏大,则所测得的纯度将会偏大,故C错误;
分析,c(待测)偏高,待测液的物质的量偏大,则所测得的纯度将会偏大,故C错误;
D.滴定前仰视读数而滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 分析,c(待测)偏低,待测液的物质的量偏低,则所测得的纯度将会偏小,故D正确。
分析,c(待测)偏低,待测液的物质的量偏低,则所测得的纯度将会偏小,故D正确。
故答案为:BD。
③根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=0.1000mol/L×20.00×10-3L=2×10-3mol,知消耗的Na2S2O3的物质的量=2n(I2)=2×0.1000mol/L×20.00×10-3L=4×10-3mol,根据现称取7.900g硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的硫代硫酸钠质量为0.7900g,故样品中硫代硫酸钠纯度为![]() =
=![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1/2×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×109/1×104mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是_。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
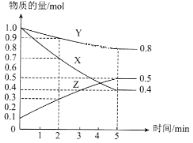
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A.X、Y、Z的反应速率相等 B.容器内气体密度保持不变 C.容器内气体压强保持不变 D.消耗3molX的同时生成1mol Y
③2min内X的转化率为__________。
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
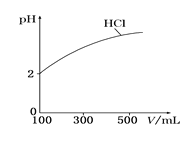
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
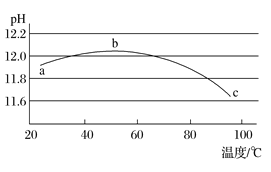
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响