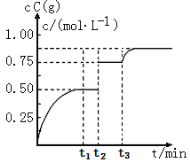
��Ŀ����
����Ŀ���棨Ce)��һ����Ҫ��ϡ��Ԫ�ء��Ը���CeO2�ķϲ�����ĩ����SiO2�� Fe2O3�Լ���������������ϡ������ʣ�Ϊԭ�ϣ����ö��ַ��������档��ش��������⣺
(1)ʪ������������������IJ����������£�(��֪��CeO2������ϡ���ᣬҲ������NaOH��Һ��)
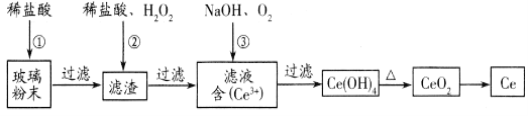
�����ijɷ���_____________________����Ӧ�������ӷ���ʽ��_____________________________��
(2)�ɷ������������������ǰ�Ce(OH)3������������Ce(OH)4�����������з����Ļ�ѧ��Ӧ����ʽΪ___________________________��
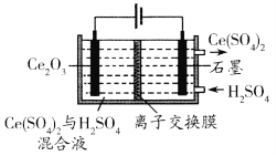
(3)���õ�ⷽ��Ҳ����ʵ����Ļ��ա������������µ��Ce2O3����ͼ���������缫��ӦʽΪ________________�����ӽ���ĤΪ________ (���������������������ӽ���Ĥ��
���𰸡�CeO2��SiO2 2CeO2 +H2O2 +6H+=2Ce3++O2��+4H2O 4 Ce(OH)3 +2H2O+ O2=4 Ce(OH)4 Ce2O3-2e- + 6H+ = 2Ce4++3 H2O ��
��������
�ϲ�����ĩ�к�SiO2��Fe2O3��CeO2�Լ���������������ϡ������ʣ�����ϡ���ᣬFe2O3ת��FeCl3��������Һ�У�����ΪCeO2��SiO2������ϡ�������H2O2��CeO2ת��ΪCe3+������ΪSiO2������ͨ��������Ce��+3����Ϊ+4���õ���ƷCe(OH)4�����ȷֽ�����CeO2�����ɵõ�Ce���Դ˽����⡣
��1��������������֪��ΪCeO2��SiO2���ܽ������ᣬ���������ijɷ���CeO2��SiO2���ټ���ϡ���ᡢH2O2��CeO2�Ϳ��Ժ�ϡ���ᡢH2O2��Ӧ����ת��ΪCeCl3��O2��H2O�����Է�Ӧ�����ӷ���ʽΪ��6H++H2O2+2CeO2��2Ce3++O2��+4H2O���ʴ�Ϊ��CeO2��SiO2��6H++H2O2+2CeO2��2Ce3++O2��+4H2O��
��2���ɷ������������������ǰ�Ce(OH)3������������Ce(OH)4�����������з����Ļ�ѧ��Ӧ����ʽΪ4Ce(OH)3+O2+2H2O��4Ce(OH)4���ʴ�Ϊ��4Ce(OH)3+O2+2H2O��4Ce(OH)4��
��3������������������Ӧ���缫����ʽΪCe2O3��2e��+6H+��2Ce4++3H2O����Ӧ���������ӣ��Ҳ���Һ�е�H+��Ҫ�ƶ�����࣬��Ӧ�������ӽ���Ĥ���ʴ�Ϊ��Ce2O3��2e��+6H+��2Ce4++3H2O������

����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
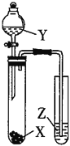
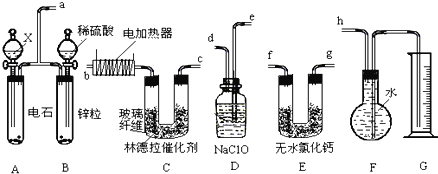
ѡ�� | �Լ� | ʵ��Ŀ�� | ʵ��װ�� | ||
X | Y | Z |
| ||
A | MnO2 | Ũ���� | KI-������Һ | �Ƚ�Cl2��I2��������ǿ�� | |
B | ʯ��ʯ | Ũ���� | Na2SiO3��Һ | CԪ�طǽ����Դ���SiԪ�� | |
C | ���� | Ũ���� | ��ˮ | ֤��Ũ���������ˮ�ԡ������� | |
D | Na2SO3 | ϡHNO3 | Ʒ����Һ | ֤��SO2����Ư���� | |
A.AB.BC.CD.D