题目内容
13.下列各组比较不正确的是( )| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 | |
| C. | 熔沸点:Li>Na>K | |
| D. | 原子半径:Li<Na<K |
分析 依据同主族元素性质递变规律:从上到下,碱金属原子半径依次增大,熔沸点降低,元素金属性依次增强,据此解答.
解答 解:A.锂在钠的上方,金属性弱于钠,与水反应剧烈程度弱于钠,故A正确;
B.虽然单质的还原性顺序为:K>Na>Li,但K不能置换出NaCl溶液中的钠,而是先和水反应,故B错误;
C.碱金属元素从Li到Cs,原子半径依次增大,金属键依次减弱,熔、沸点逐渐降低,即Li>Na>K,故C正确;
D.碱金属元素从Li到Cs,电子层数依次增多,原子半径逐渐增大,即Li<Na<K,故D正确;
故选:B.
点评 本题考查碱金属知识,为高频考点,熟悉同主族元素性质递变规律是解题关键,题目难度不大.

练习册系列答案
相关题目
3.如图是一个氢核磁共振谱,请你观察图谱,分析其可能是下列物质中( )


| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2OH | C. | 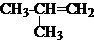 | D. | 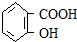 |
4.新闻:美国《科学》杂志12月17日评选出2004十大科学突破中,有多项与水有关,其中之一是关于对水的研究有新进展,一些科学家对于水分子如何聚合以及电子及质子如何在水中溶解等问题上,都有了新发现.另据 2004年4月14日中科院网报道,中科院物理所王恩哥小组他们首次证明存在一种稳定的二维冰相.它是由四角形和八角形的氢键网格交替组成的,研究人员把这种新的冰结构命名为镶嵌冰.有趣的是,这种镶嵌冰可以在室温下稳定存在.有关这种镶嵌冰的推测肯定不正确的( )
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
1.如表所示的五种元素W、X、Y、T、Z均为短周期元素,且这五种元素的原子最外层电子数之和为26.下列说法正确的是( )
| W | X | Y | |
| T | Z | ||
| M |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质TY2、WZ4在通常情况下状态相同 | |
| D. | M元素的单质具有半导体的特性,M与Z元素可形成化合物MZ4 |
8.下列关于元素周期表的说法正确的是( )
| A. | 周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 周期表里,元素所在的周期序数等于原子核外最外层电子数 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
18.NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 19gH3O+共用的电子对数为2NA | |
| B. | 34gD2O2所含电子数为18NA | |
| C. | 1mol羟基(-16OH) 所含中子数为8NA | |
| D. | D16OD、T16OH共10g,所含中子数各为0.25NA |
5. 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3molClO-参加反应时,则有1molN2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5molClO-参加反应时,则有1molN2生成 | |
| D. | 若生成2.24LN2,则转移电子0.6mol |
2.下列装置或操作能达到实验目的是( )
| A. |  实验室制取并收集NH3 | B. | 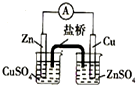 构成原电池 | ||
| C. | 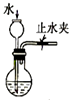 检查装置气密性 | D. |  利用排空气法收集CO2 |