题目内容
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L乙烷中含有的极性键数目为0.6NA | |
| C. | 室温下,3g甲醛和乙酸的混合物中含有的原子数目为0.8NA | |
| D. | 56g铁与足量稀硫酸反应转移的电子数为3NA |
分析 A.pH=13的氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子;
B.乙烷分子中含有的极性键为碳氢键,乙烷分子中含有6个碳氢键;
C.甲醛和乙酸最简式为CH2O,计算3.0gCH2O中含有的原子数即可;
D.铁与稀硫酸反应生成的是亚铁离子,56g铁为1mol,完全反应转移了2mol电子.
解答 解:A.pH=13的1.0LBa(OH)2溶液中含有氢氧根离子的物质的量为:0.1mol/L×1L=0.1mol,所以含有的OH-数目等于0.1NA,故A错误;
B.标况下2.24L乙烷的物质的量为0.1mol,0.1mol乙烷分子中含有0.6mol极性键碳氢键,含有的极性键数目为0.6NA,故B正确;
C.甲醛和乙酸最简式为CH2O,3.0 g甲醛和乙酸的混合物中含有碳原子的个数,只需要计算3.0gCH2O中碳原子物质的量=$\frac{3.0g}{30g/mol}$=0.1mol,0.1molCH2O中含有0.4mol原子,含有的原子数为0.4NA,故C错误;
D.56g铁的物质的量为为:$\frac{56g}{56g/mol}$=1mol,1mol铁与稀硫酸完全反应生成1mol亚铁离子,转移了2mol电子,转移的电子数为2NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;D为易错点,注意反应生成亚铁离子.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
7. 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )| A. | 该材料是一种新型金属有机材料 | |
| B. | 该材料能捕集CO2,是因为CO2与该材料发生了化学反应 | |
| C. | 该材料捕集11.2L CO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2完全捕集,从而控制温室效应 |
8.下列离子方程式正确的是( )
| A. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2 NO↑+4H2O | |
| D. | MgSO4溶液与Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ |
12.下列说法不正确的是( )
| A. | 工艺师可利用氢氟酸刻蚀石英制作艺术品,说明氢氟酸的酸性很强 | |
| B. | 水晶项链和光导纤维的主要成分是相同的 | |
| C. | 粗硅的制备及提纯单晶硅均涉及到氧化还原反应 | |
| D. | 我国自主研发的“龙芯1号”CPU芯片与神舟六号飞船使用的太阳能电池都用到硅 |
10.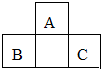 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | B、Mg、Si | D. | O、P、Cl |
 的电离程度分别用α1、α2表示,则α1小于α2(填“大于”、“小于”、“等于”或“无法确定”)
的电离程度分别用α1、α2表示,则α1小于α2(填“大于”、“小于”、“等于”或“无法确定”)