题目内容
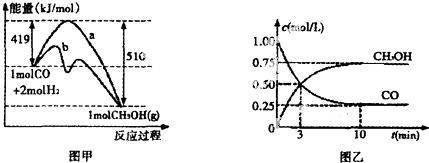
16.向20mL 1mol•L-1的Al2(SO4)3溶液中加入20mLNaOH溶液,充分反应可得1.56g沉淀,则加入的NaOH溶液的物质的量浓度可能是3mol/L、7mol/L.分析 分情况讨论:
1、氢氧化钠不足量,氢氧根全部转化为沉淀;
2、氢氧化钠过量,先生成沉淀,后沉淀部分溶解.
解答 解:1、氢氧化钠不足量,氢氧根全部转化为沉淀.
设 NaOH溶液的物质的量浓度是xmol/L,
3OH-+Al3+=Al(OH)3↓
3 78g
0.02xmol 1.56g
$\frac{3}{0.02x}=\frac{78g}{1.56g}$,则:x=3
2、硫酸铝不足量,先生成沉淀,后沉淀部分溶解.
硫酸铝中Al3+的物质的量为2×1mol/L×0.02L=0.04mol,1.56g沉淀需要Al3+的物质的量为
$\frac{1.56g}{78g/mol}$=0.02mol,转变成AlO2-的Al3+的物质的量为0.02mol.
设NaOH溶液的物质的量浓度是ymol/L,
3OH-+Al3+=Al(OH)3↓
3 mol 78g
0.06mol 1.56g
4OH-+Al3+=AlO2-+2H2O
4mol 1mol
0.08mol 0.02mol
所以NaOH溶液的物质的量浓度是c=$\frac{n}{V}$=$\frac{0.08+0.06}{0.02}$=7mol/L,
故答案为:3mol/L;7mol/L.
点评 本题考查的是物质的量浓度的相关计算,侧重考查学生全面分析问题的能力,因氢氧化铝的两性,要注意考虑沉淀先生成后溶解现象,防止答案遗漏.

练习册系列答案
相关题目
6.短周期中元素a、b、c在周期表中位置如图所示,下列有关这三种元素的叙述中正确的是( )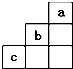

| A. | b的氢化物很稳定 | |
| B. | a是一种活泼的非金属元素 | |
| C. | c的最高价氧化物的水化物是一种弱酸 | |
| D. | b元素在化合物中的最高价为+7价 |
7.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | AlCl3和NaOH | B. | NaAl02和H2S04 | C. | Na2C03和HCl | D. | NaHS04和Ba(OH)2 |
4.使溶液中的AlO2-完全转化成Al(OH)3,应选择的最好试剂是( )
| A. | 盐酸 | B. | 硫酸 | C. | CO2 | D. | 氨水 |
11.在下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.5L0.1mol/L的NaCl溶液 | B. | 1L0.2mol/L的MgCl2溶液 | ||
| C. | 1L0.3mol/L盐酸溶液 | D. | 100mL0.2mol/L的AlCl3溶液 |
1.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| D. | 将水加热,KW增大,pH不变 |
8.在反应4HCl+O2═2C12+2H2O中,已知2molO2被还原时,放出akJ的热量,且断开1 mol O2需要吸收b kJ的热量,断开1mol Cl2需要吸收c kJ的热量.则断开1mol H-0键比断开1mol H-Cl键所需能量高( )
| A. | $\frac{a+b-2c}{4}$kJ | B. | $\frac{a+2b-4c}{8}$kJ | C. | $\frac{b-a-2c}{4}$kJ | D. | $\frac{2b-a-4c}{8}$kJ |
 CH3CH2COOCH(CH3)2+H2O.
CH3CH2COOCH(CH3)2+H2O. .(用结构简式表示)
.(用结构简式表示)