题目内容
15.设NA为阿伏伽德罗常数的值,则下列叙述正确的是( )| A. | 1mol Na2O2固体中含有的阴离子数为2NA | |
| B. | 常温常压下,3.2g CH4中含有的电子数为2NA | |
| C. | 标准状况下,11.2L乙酸乙酯中含有的分子数为0.5NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的CH3COOH分子数为0.1NA |
分析 A、Na2O2固体由2个钠离子和过氧根构成;
B、求出甲烷的物质的量,然后根据甲烷为10电子微粒来分析;
C、标况下,乙酸乙酯为液态;
D、醋酸是弱电解质.
解答 解:A、Na2O2固体由2个钠离子和过氧根构成,故1mol过氧化钠中含1mol阴离子即NA个,故A错误;
B、3.2g甲烷的物质的量n=$\frac{3.2g}{16g/mol}$=0.2mol,而甲烷为10电子微粒,故0.2mol甲烷中含2mol电子即2NA个,故B正确;
C、标况下,乙酸乙酯为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、醋酸是弱电解质,在溶液中部分电离,故溶液中的醋酸分子个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
10.下列说法正确的是( )
| A. | 等质量的N2和C2H4体积一定相等 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
7. 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )| A. | 该材料是一种新型金属有机材料 | |
| B. | 该材料能捕集CO2,是因为CO2与该材料发生了化学反应 | |
| C. | 该材料捕集11.2L CO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2完全捕集,从而控制温室效应 |
12.下列说法不正确的是( )
| A. | 工艺师可利用氢氟酸刻蚀石英制作艺术品,说明氢氟酸的酸性很强 | |
| B. | 水晶项链和光导纤维的主要成分是相同的 | |
| C. | 粗硅的制备及提纯单晶硅均涉及到氧化还原反应 | |
| D. | 我国自主研发的“龙芯1号”CPU芯片与神舟六号飞船使用的太阳能电池都用到硅 |
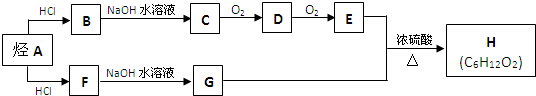
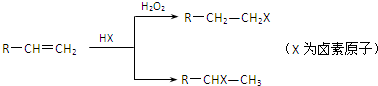
 CH3CH2COOCH(CH3)2+H2O.
CH3CH2COOCH(CH3)2+H2O. .(用结构简式表示)
.(用结构简式表示)
 的电离程度分别用α1、α2表示,则α1小于α2(填“大于”、“小于”、“等于”或“无法确定”)
的电离程度分别用α1、α2表示,则α1小于α2(填“大于”、“小于”、“等于”或“无法确定”)