题目内容
6.20世纪,全球人口增两倍,人类用水则激增五倍,约12亿人用水短缺,水资源短缺尤其是水质性缺水成了世界共同面对的资源危机,生活、工业、农业污水是污水主要来源,污水的处理原理顺理成章成为新兴朝阳产业.(1)硬水和软水的区别是硬水中的钙镁离子含量较高,如何区分硬水和软水加入少量肥皂水,能产生泡沫的为软水,不产生泡沫,而产生白色沉淀的为硬水(写出一种方法即可).
(2)硬水会给人类生产生活带来危害,试写出其中的一条:浪费肥皂,导致衣服洗不干净(或锅炉内结成锅垢,降低了锅炉的导热性、浪费燃料,甚至产生锅炉的爆炸等).
(3)硬水的软化十分重要,硬水的硬度有暂时硬度和永久硬度之分.硬水软化的方法通常有加热法、离子交换法、药剂法等.
a.加热法通常用于降低硬水的暂时硬度,请任写一个加热法转化硬水时所发生的化学反应方程式Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+H2O+CO2↑.
b.用NaR表示离子交换树脂中的有机高分子电解质,任写一个表示离子交换法软化水的离子反应方程式Ca2++2NaR=CaR2+2Na+、Mg2++2NaR=MgR2+2Na+.
c.常用的用于药剂法软化水的化学药剂有纯碱、生石灰(写俗名).
(4)用离子交换法除去Q立方米溶液中的Mn+,已知Mn+浓度为cmol/L,NaR的相对分子质量为Mg/mol,则需要离子交换树脂1000McnQg(设离子交换树脂全由NaR组成).
分析 (1)硬水是溶有较多含钙、镁物质的水; 软水是溶有较少或不含钙、镁物质的水;加肥皂水,易起浮渣儿的是硬水,有很多泡沫的是软水;
(2)用硬水洗衣粉,钙镁离子会导致浪费肥皂、洗的衣服不干净;长期使用硬水的锅炉会浪费燃料、甚至爆炸;
(3)a.加热的方法只能暂时解决硬水的硬度,写出碳酸氢钙加热分解生成碳酸钙沉淀和水、二氧化碳的反应方程式;
b.阳离子交换树脂是把水中的钙离子和镁离子通过阳离子交换除去;
c.药剂法软化该天然水,可加CaO、Na2CO3;
(4)根据n=cV计算出Mn+的物质的量,再根据电荷守恒计算出需要NaR的物质的量,再根据m=nM计算出其质量.
解答 解:(1)钙镁离子含量较高的水为硬水,可以用肥皂水区别硬水和软水,方法为:加入少量肥皂水,搅拌后泡末多的是软水,产生白色沉淀的是硬水,
故答案为:硬水中的钙镁离子含量较高;加入少量肥皂水,能产生泡沫的为软水,不产生泡沫,而产生白色沉淀的为硬水;
(2)使用硬水会给生活和生产带来许多麻烦,如:浪费肥皂,导致衣服洗不干净;锅炉内结成锅垢,降低了锅炉的导热性、浪费燃料,甚至产生锅炉的爆炸等,
故答案为:浪费肥皂,导致衣服洗不干净(或锅炉内结成锅垢,降低了锅炉的导热性、浪费燃料,甚至产生锅炉的爆炸等)
(3)a.加热硬水后,碳酸氢盐会转化成碳酸盐沉淀,如加热碳酸氢钙,分解生成碳酸钙、水、二氧化碳,化学反应为:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$ CaCO3↓+H2O+CO2↑,该方法只能暂时解决硬水的硬度,
故答案为:暂时;Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$ CaCO3↓+H2O+CO2↑;
b.离子交换树脂可以除去钙离子和镁离子得到软水,离子交换树脂发生的反应为:Ca2++2NaR=CaR2+2Na+、Mg2++2NaR=MgR2+2Na+,
故答案为:Ca2++2NaR=CaR2+2Na+、Mg2++2NaR=MgR2+2Na+;
c.药剂法软化该天然水,可先加CaO,后加Na2CO3,可使过量Ca2+除去,发生的反应为Ca(HCO3)2+Ca(0H)2═2CaCO3↓+2H2O、Mg(HCO3)2+2Ca(0H)2═2CaCO3↓+Mg(OH)2↓+2H2O、MgCl2+Ca(0H)2═Mg(OH)2↓+CaCl2、CaCl2+Na2CO3═CaCO3↓+2NaCl,
故答案为:纯碱、生石灰;
(4)用离子交换法除去Q立方米溶液中的Mn+,已知Mn+浓度为cmol/L,则含有Mn+的物质的量为:cmol/L×1000×QL=1000cQmol,
Mn+反应后生成MRn,则需要NaR的物质的量为:1000ncQmol,质量为:Mg/mol×1000ncQmol=1000McnQg,
故答案为:1000McnQ.
点评 本题考查了性质实验方案的设计、离子方程式的计算等知识,题目难度中等,试题知识点较多,侧重考查硬水及其处理方法,注意掌握硬水和软水的区别及硬水的危害、处理方法.

| A. | 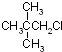 | B. | 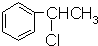 | C. | 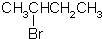 | D. |  |
| A. | NaOH | B. | SiO2 | C. | Fe | D. | H2Se |
| A. | 电解熔融AlCl3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氯化钠与铝粉高温共热 |
| A. | 有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而制得的 | |
| B. |  的单体是HOCH2OH与 的单体是HOCH2OH与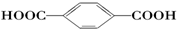 | |
| C. | 聚乙烯( )是由乙烯加聚生成的纯净物 )是由乙烯加聚生成的纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
| A. | 等压时,通入惰性气体,c的物质的量不变 | |
| B. | 等压时,通入z气体反应器中温度升高 | |
| C. | 等容时,通入惰性气体,各反应速率不变 | |
| D. | 等容时,通入z气体,通入z气体的转化率较小 |
 .
.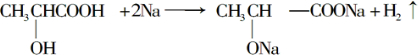 .
.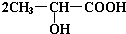 +Na2CO3→
+Na2CO3→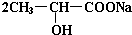 +H2O+CO2↑.
+H2O+CO2↑. .
. 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下: