题目内容
18.欲得到较纯净氯乙烷的方法是( )| A. | 乙烷与氯气发生取代反应 | B. | 乙烯与氯气发生加成反应 | ||
| C. | 乙烯与氯化氢发生加成反应 | D. | 乙炔与氯化氢发生加成反应 |
分析 欲得到较纯净的氯乙烷(CH3-CH2Cl),即不能混用杂质,则乙烯与HCl发生加成反应即可,且没有副产物,以此来解答.
解答 解:A.乙烷与氯气发生取代反应,产物复杂,即副产物很多,比如二氯乙烷等,制取的氯乙烷不纯,故A不选;
B.乙烯与氯气发生加成反应,生成1,2-二氯乙烷,故B不选;
C.乙烯与氯化氢发生加成反应,生成氯乙烷,且没有副产物,方法最好,故C选;
D.乙炔与氯化氢发生加成反应,若1mol乙炔与2molHCl加成,则产物不唯一,故D不选;
故选C.
点评 本题考查有机物的合成,为高频考点,把握常见有机物的性质及合成中没有副反应、副产物为解答的关键,注意取代反应、加成反应的特点,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
13.下列实验方案能够达到目的是( )
| A. | 将溴乙烷与NaOH溶液混合后振荡、静置,直接向反应后的混合物中滴加AgNO3溶液,检验Br-的存在 | |
| B. | 将淀粉与稀H2SO4混合后加热,3min~4min后,直接向反应后的混合物中加入银氨溶液,检验葡萄糖的存在(已知淀粉在酸性条件下能水解成葡萄糖,葡萄糖含醛基) | |
| C. | 向试管中加入5mL溴水、2mL苯和0.5g铁粉,充分振荡后静置,观察试管底部生成的褐色油状液体 | |
| D. | 在试管中加入约2mL饱和溴水,然后滴入2滴~3滴苯酚稀溶液,观察苯酚与溴反应生成的白色沉淀 |
10. A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
请回答下列问题:
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
7.某烃的结构简式为CH3-CH2-CH=C(C2H5)-C≡CH,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
| A. | 4、3、6 | B. | 4、3、5 | C. | 2、5、4 | D. | 4、6、4 |
8.下列有机物命名正确的是( )
| A. | 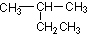 2-乙基丙烷 2-乙基丙烷 | B. | 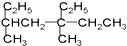 3,5-二甲基-3-乙基庚烷 3,5-二甲基-3-乙基庚烷 | ||
| C. | 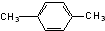 间二甲苯 间二甲苯 | D. | 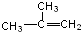 2-甲基-2-丙烯 2-甲基-2-丙烯 |
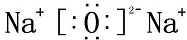 NaOH
NaOH Na2O2
Na2O2
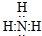 CO2
CO2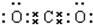 HClO
HClO .
.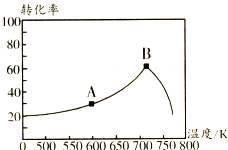 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
 .
.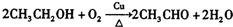 .
.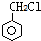 的属于芳香族化合物的同分异构体有3种.
的属于芳香族化合物的同分异构体有3种.