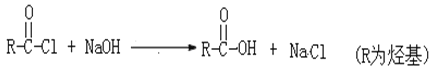
题目内容
【题目】Ⅰ、甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②反应Ⅰ中,若△H1﹤0,则要提高甲醇的产率,可采取的措施有_____(填字母)
A.缩小容器的体积 B.降低温度 C.升高温度
D.使用合理的催化剂 E.将甲醇从混合体系中分离出来
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1453kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-466kJ/mol
请写出32g甲醇液体发生不完全燃烧生成一氧化碳和液态水的热化学反应方程式: 。
Ⅱ.由CO2和H2合成CH3OH的反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
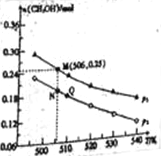
①上述反应的△H (填“﹥”或“﹤”)0
②图中压强p1 (填“﹥”或“﹤”)p2
③经测定知Q点时容器的压强是反应前压强的0.9,若反应从开始到平衡所需的时间为10min,则0~10min内H2的反应速率v(H2)= 。
④N点时,该反应的平衡常数K= (计算结果保留2位小数)。
【答案】Ⅰ、(1)①反应I符合“原子经济性”的原则即原子利用率为100%②A B E
(2)CH3OH(l)+O2(g)=CO(g)+H2O(l) △H=-493.5kJ/mol
Ⅱ、①﹤②﹥③5.625×10-3mol·L-1·min-1④1.04
【解析】
试题分析:
Ⅰ、(1)①根据反应Ⅰ和反应Ⅱ的生成物可知,反应I中生成物只有一种,而反应Ⅱ中还有水生成,即反应Ⅰ符合“原子经济性”的原则即原子利用率为100%,所以反应Ⅰ优于反应Ⅱ。
②反应CO(g)+2H2(g)![]() CH3OH(g)为气体系数减小的放热反应,要提高甲醇的产率,可采取的措施有增大压强即缩小容器的体积、降低温度、将甲醇从混合体系中分离出来等方式。
CH3OH(g)为气体系数减小的放热反应,要提高甲醇的产率,可采取的措施有增大压强即缩小容器的体积、降低温度、将甲醇从混合体系中分离出来等方式。
(2)根据盖斯定律,(①-②)÷2可得:CH3OH(l)+O2(g)=CO(g)+H2O(l) △H=-493.5kJ/mol;Ⅱ.①由图像可知,温度越高,甲醇的物质的量越小,则反应为放热反应,△H﹤0;
②对于反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为气体系数减小的反应,压强增大,甲醇的物质的量增大,由图像可知,p2到p1,甲醇的物质的量增大,可得p1﹥p2;
CH3OH(g)+H2O(g),为气体系数减小的反应,压强增大,甲醇的物质的量增大,由图像可知,p2到p1,甲醇的物质的量增大,可得p1﹥p2;
③Q点时容器的压强是反应前压强的0.9倍,可知Q点时的物质的量是反应前的0.9倍。依据平衡三段式列式计算;
CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始量(mol) 1 2.75 0 0
变化量(mol) x 3x x x
平衡量(mol)1-x 2.75-3x x x
则(1-x )+(2.75-3x)+ x+x =3.75×0.9,可得x=0.1875
v(H2)=5.625×10-3mol·L-1·min-1;
④由图像知,M点和N点温度相同,故平衡常数K相同,M点时,平衡体系中CH3OH浓度为0.025mol/L,可得CO2、H2、H2O浓度分别为0.075mol/L、0.2mol/L、0.025mol/L。根据平衡常数表达式可得:K==1.04,可得,N点时该反应的平衡常数K=1.04。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案