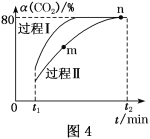
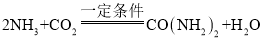题目内容
【题目】海水中食盐储量丰富,工业上常用食盐制取多种产品。下列物质不能通过食盐一步制取的是
A. 金属钠B. 烧碱C. 纯碱D. 氯气
【答案】C
【解析】
A、电解熔融状态的氯化钠得到金属钠,其化学反应方程式为2NaCl![]() 2Na+Cl2↑,故A不符合题意;
2Na+Cl2↑,故A不符合题意;
B、电解饱和食盐水,其反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,其中NaOH为烧碱,故B不符合题意;
2NaOH+H2↑+Cl2↑,其中NaOH为烧碱,故B不符合题意;
C、用NaCl制备纯碱,方法是NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,然后加热NaHCO3,发生2NaHCO3![]() Na2CO3+CO2↑+H2O,不能直接一步得到纯金,故C符合题意;
Na2CO3+CO2↑+H2O,不能直接一步得到纯金,故C符合题意;
D、电解饱和食盐水,其反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,能直接得到氯气,故D不符合题意;
2NaOH+H2↑+Cl2↑,能直接得到氯气,故D不符合题意;
答案为C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目