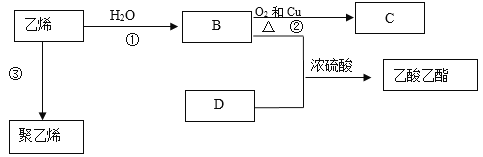
题目内容
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水。下列说法不正确是
A.步骤①,硫酸酸溶后溶液中主要有Fe3+、Fe2+等阳离子
B.步骤②的反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,消耗1molFeS2转移16mol电子
C.步骤③,得到的绿矾晶体久置于空气中会变质
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
【答案】B
【解析】
根据流程:烧渣中的Fe3O4、Fe2O3和FeO均溶于硫酸,溶液中含Fe2+、Fe3+,三价铁具有氧化性,因此步骤②中发生FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应得到硫酸亚铁溶液,步骤③为蒸发浓缩、冷却结晶析出绿矾,绿矾与氨水、空气可发生氧化还原反应生成铁黄[FeO(OH)],据此分析解答。
A.步骤①中用硫酸酸溶时,Fe3O4、Fe2O3和FeO均溶于硫酸,生成Fe2+、Fe3+的溶液,故A正确;
B.三价铁具有氧化性,步骤②中的反应为FeS2+14Fe3++8H2O═15Fe2++2SO42ˉ+16H+,反应中Fe3+中铁元素由+3价降低为+2价,FeS2中S由-1价升高到+6价,因此消耗1mol FeS2转移 14mol 电子,故B错误;
C.Fe2+有较强的还原性,所以绿矾晶体久置于空气中会被氧气氧化而变质,故C正确;
D.步骤④,反应条件控制不当,如果氨水过量,绿矾可与氨水反应生成Fe(OH)3,故D正确;
故选B。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
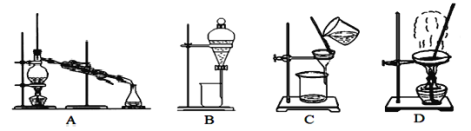
小夫子全能检测系列答案【题目】实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯(SO2Cl2),原理为SO2+Cl2![]() SO2Cl2,装置如图所示(夹持仪器已省略):
SO2Cl2,装置如图所示(夹持仪器已省略):
已知有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 不易分解 |
请回答下列问题:
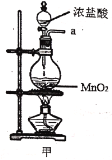
(1)写出甲中制取Cl2的化学方程式___。
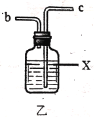
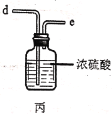
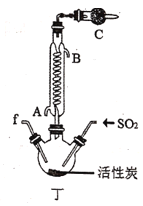
(2)利用图中甲、乙、丙装置制取干燥纯净的Cl2,并在丁装置合成硫酰氯,要完成实验目的,按气流从左到右,各接口正确的连接顺序是___。
A.abcdef B.abcedf C.acbdef D.acbedf
乙中试剂X是___。
(3)丁中冷凝管进水口为___(填“A”或“B”)。装置C的作用是___。
(4)硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___。