题目内容
科学家要研究跟碳元素及其化合物相关的很多课题。
(1)焦炭可用于制取水煤气。测得12g碳与水蒸气完全反应生成水煤气时,吸收了131. 6kJ热量,该反应的热化学方程式是_________ 。
(2)工业上可用焦炭冶炼金属,若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是_________。
(3)碳跟水蒸气制水煤气的反应是一个可逆反应,下列情况下能判断该反应一定达到平衡状态的是_________(选填编号.)。
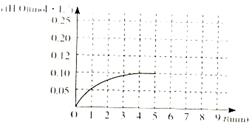
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0molCO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应C(s)+H2O(g)  CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
(1)焦炭可用于制取水煤气。测得12g碳与水蒸气完全反应生成水煤气时,吸收了131. 6kJ热量,该反应的热化学方程式是_________ 。
(2)工业上可用焦炭冶炼金属,若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是_________。
(3)碳跟水蒸气制水煤气的反应是一个可逆反应,下列情况下能判断该反应一定达到平衡状态的是_________(选填编号.)。
| A.V正(H2O)=V正(H2) |
| B.容器中温度不再发生改变 |
| C.消耗nmolH2同时消耗nmolCO |
| D.容器中气体的总物质的量不随时间改变 |
 CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
(1)C(s)+H2O(g) CO(g)+H2(g) ?H=+131.6KJ/mol;(2)5C+3Fe2O3
CO(g)+H2(g) ?H=+131.6KJ/mol;(2)5C+3Fe2O3 CO2↑+4CO↑+6Fe;(3)B D (4)8.1
CO2↑+4CO↑+6Fe;(3)B D (4)8.1
 CO(g)+H2(g) ?H=+131.6KJ/mol;(2)5C+3Fe2O3
CO(g)+H2(g) ?H=+131.6KJ/mol;(2)5C+3Fe2O3 CO2↑+4CO↑+6Fe;(3)B D (4)8.1
CO2↑+4CO↑+6Fe;(3)B D (4)8.1 
试题分析:(1)根据题意可得方程式为:C(s)+H2O(g)
 CO(g)+H2(g) ?H=+131.6KJ/mol;(2) 赤铁矿主要成分是Fe2O3,由于0.5mol碳完全反应得到0.6mol铁,说明反应的Fe2O3的物质的量为0.3mol,因为同时生成2种常见气体,则根据质量守恒定律可得该反应的化学方程式是5C+3Fe2O3
CO(g)+H2(g) ?H=+131.6KJ/mol;(2) 赤铁矿主要成分是Fe2O3,由于0.5mol碳完全反应得到0.6mol铁,说明反应的Fe2O3的物质的量为0.3mol,因为同时生成2种常见气体,则根据质量守恒定律可得该反应的化学方程式是5C+3Fe2O3 CO2↑+4CO↑+6Fe;(3)A.在任何时刻都存在V正(H2O)=V正(H2)。所以不能由此确定反应达到平衡状态。错误。B. 由于该反应伴随着能量变化。如果反应未达到平衡,无论向那个方向进行,容器内的温度必然发生改变。若容器中温度不再发生改变,则单位时间内任何物质的浓度就不再变化,即反应达到了平衡状态。正确。C.H2、CO都是生成物,在任何时刻都存在着消耗nmolH2同时消耗nmolCO 的关系,所以不能由此确定反应达到平衡状态。错误。D.该反应是个反应前后气体体积不等的反应,若容器中气体的总物质的量不随时间改变,必然反应达到了平衡状态。正确。(4)化学平衡常数是可逆反应达到平衡状态时个生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。当反应达到平衡状态时,c(H2O)="0.10mol/L," c(H2)="c(CO)=0.9mol/L."
CO2↑+4CO↑+6Fe;(3)A.在任何时刻都存在V正(H2O)=V正(H2)。所以不能由此确定反应达到平衡状态。错误。B. 由于该反应伴随着能量变化。如果反应未达到平衡,无论向那个方向进行,容器内的温度必然发生改变。若容器中温度不再发生改变,则单位时间内任何物质的浓度就不再变化,即反应达到了平衡状态。正确。C.H2、CO都是生成物,在任何时刻都存在着消耗nmolH2同时消耗nmolCO 的关系,所以不能由此确定反应达到平衡状态。错误。D.该反应是个反应前后气体体积不等的反应,若容器中气体的总物质的量不随时间改变,必然反应达到了平衡状态。正确。(4)化学平衡常数是可逆反应达到平衡状态时个生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。当反应达到平衡状态时,c(H2O)="0.10mol/L," c(H2)="c(CO)=0.9mol/L." 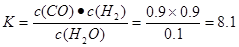 因为该反应的正反应为吸热反应,所以升高温度,化学平衡向正反应方向移动,当到8分钟时达到那番话状态。其变化曲线见答案。
因为该反应的正反应为吸热反应,所以升高温度,化学平衡向正反应方向移动,当到8分钟时达到那番话状态。其变化曲线见答案。
练习册系列答案
相关题目
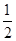 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1 2SO3(g)
2SO3(g) 


 CH3OH(g) ΔH
CH3OH(g) ΔH


 4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,
 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度