题目内容
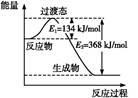
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH="-196.6" kJ/mol。


请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高温度
b.充入He气
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
 2SO3(g)
2SO3(g) ΔH="-196.6" kJ/mol。


请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高温度
b.充入He气
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
(1)S(s)+O2(g) SO2(g) ΔH="-297" kJ/mol
SO2(g) ΔH="-297" kJ/mol
(2)-78.64 kJ/mol
(3)大 (4)2 mol 2SO2+O2+4OH- 2S
2S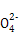 +2H2O
+2H2O
(5)c (6)升高温度 t3~t4
 SO2(g) ΔH="-297" kJ/mol
SO2(g) ΔH="-297" kJ/mol(2)-78.64 kJ/mol
(3)大 (4)2 mol 2SO2+O2+4OH-
 2S
2S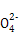 +2H2O
+2H2O(5)c (6)升高温度 t3~t4
(1)注意物质状态,通过图示得出ΔH。
(2)根据2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH="-196.6" kJ/mol以及生成0.8 mol SO3,可计算出ΔH2为
-196.6 kJ/mol÷2×0.8="-78.64" kJ/mol。
(3)根据起始量O2多,反应生成SO3多,故ΔH的数值大。
(4)SO2、SO3都与NaOH反应共消耗2 mol NaOH,SO2还原性较强与剩余的O2反应:
2SO2+O2+4OH- 2S
2S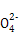 +2H2O。
+2H2O。
(5)对于反应2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH="-196.6" kJ/mol,要使n(SO3)/ n(SO2)增大即使反应正向进行,温度升高反应逆向进行,充入He气不影响平衡,再充入1 mol SO2(g)和1 mol O2(g)相当于增大压强使反应正向进行。使用催化剂不影响
平衡。
(6)t2时刻速率增大,反应正向进行,改变的是增大压强,t4时刻速率增大,反应逆向进行,改变的是升高温度,t6时刻速率增大,平衡不移动,改变的是催化剂,据此可知SO3浓度最高的时间段是t3~t4。
(2)根据2SO2(g)+O2(g)
 2SO3(g)
2SO3(g) ΔH="-196.6" kJ/mol以及生成0.8 mol SO3,可计算出ΔH2为
-196.6 kJ/mol÷2×0.8="-78.64" kJ/mol。
(3)根据起始量O2多,反应生成SO3多,故ΔH的数值大。
(4)SO2、SO3都与NaOH反应共消耗2 mol NaOH,SO2还原性较强与剩余的O2反应:
2SO2+O2+4OH-
 2S
2S +2H2O。
+2H2O。(5)对于反应2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)ΔH="-196.6" kJ/mol,要使n(SO3)/ n(SO2)增大即使反应正向进行,温度升高反应逆向进行,充入He气不影响平衡,再充入1 mol SO2(g)和1 mol O2(g)相当于增大压强使反应正向进行。使用催化剂不影响
平衡。
(6)t2时刻速率增大,反应正向进行,改变的是增大压强,t4时刻速率增大,反应逆向进行,改变的是升高温度,t6时刻速率增大,平衡不移动,改变的是催化剂,据此可知SO3浓度最高的时间段是t3~t4。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 、CO2占
、CO2占 ,且C(s)+
,且C(s)+ O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
 O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
 HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
 CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。