题目内容
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+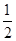 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________________________________________________________。
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+
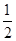 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________________________________________________________。
(1)①制玻璃 ②ΔH1+3ΔH2+18ΔH3
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1
(1)①CaSiO3为玻璃的成分之一,从而确定矿渣用途。②根据盖斯定律知ΔH=ΔH1+3ΔH2+18ΔH3。
(2)由热化学方程式①+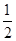 ×②+③得:
×②+③得:
Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)
ΔH=ΔH1+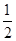 ×ΔH2+ΔH3=+64.39 kJ·mol-1+
×ΔH2+ΔH3=+64.39 kJ·mol-1+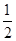 ×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。
×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。
(2)由热化学方程式①+
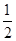 ×②+③得:
×②+③得:Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)
ΔH=ΔH1+
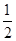 ×ΔH2+ΔH3=+64.39 kJ·mol-1+
×ΔH2+ΔH3=+64.39 kJ·mol-1+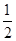 ×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。
×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。
练习册系列答案
相关题目
 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1 CO2(g) + H2(g)
CO2(g) + H2(g)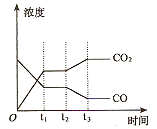
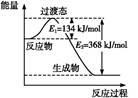
 O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。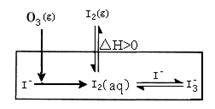
 HOI(aq) △H2
HOI(aq) △H2

 HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
 CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1