题目内容
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。

(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。

(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。
(1)-28.5 (2)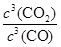 减小
减小
(3)①60% ②ad (4)①bc ②锌
(5)2.125×1021
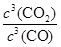 减小
减小(3)①60% ②ad (4)①bc ②锌
(5)2.125×1021
(1)根据盖斯定律可知,已知反应的ΔH=ΔH1-3ΔH2=489.0 kJ·mol-1-3×172.5 kJ·mol-1=-28.5 kJ·mol-1。
(2)冶炼铁反应的平衡常数表达式K=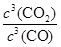 ,温度升高后,平衡向吸热反应方向移动,所以K值减小。
,温度升高后,平衡向吸热反应方向移动,所以K值减小。
(3)①反应开始时,CO、CO2的物质的量浓度均为0.5 mol·L-1,设反应中转化的CO物质的量浓度为x,则平衡时CO、CO2的物质的量浓度分别为(0.5-x)mol/L、(0.5+x) mol/L,则有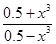 =64,等式两边开立方得
=64,等式两边开立方得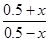 =4,解得x=0.3,则CO的转化率为0.3÷0.5×100%=60%。
=4,解得x=0.3,则CO的转化率为0.3÷0.5×100%=60%。
②该反应的气体是由CO转化为CO2,故气体的质量增加,容器体积不变,故气体密度为变化量,当气体的密度不变时,说明反应已达到平衡状态,a项正确;Fe2O3为固体,增加其用量不会影响平衡,b项错误;该反应中的反应物和生成物中气体只有一种,故尽管乙容器中的CO用量增加,但不会影响转化率,c项错误;将甲、乙中CO2的物质的量进行极端转换,得起始时CO气体的物质的量之比为2∶3,则平衡时CO物质的量浓度之比为2∶3,d项正确。
(4)①a装置中铁连接电源的正极,为阳极,发生氧化反应,加速其腐蚀,a错误;b装置中铁连接电源的负极,为阴极,能保护铁不被腐蚀,是外接电源的阴极保护法,b正确;c装置中,锌比铁活泼,锌作负极,铁被保护,是牺牲阳极的阴极保护法,c正确。
②若d装置能够保护铁,则X的活泼性应比铁活泼,使右侧装置为原电池,左侧装置为电解池,构成外接电源的阴极保护法,X可以是Zn、Al等活泼的金属。
(5)根据Ksp计算公式可得:
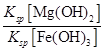 =
=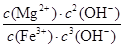 ,
,
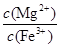 =
=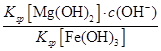 =
=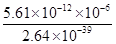 =2.125×1021。
=2.125×1021。
(2)冶炼铁反应的平衡常数表达式K=
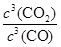 ,温度升高后,平衡向吸热反应方向移动,所以K值减小。
,温度升高后,平衡向吸热反应方向移动,所以K值减小。(3)①反应开始时,CO、CO2的物质的量浓度均为0.5 mol·L-1,设反应中转化的CO物质的量浓度为x,则平衡时CO、CO2的物质的量浓度分别为(0.5-x)mol/L、(0.5+x) mol/L,则有
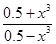 =64,等式两边开立方得
=64,等式两边开立方得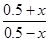 =4,解得x=0.3,则CO的转化率为0.3÷0.5×100%=60%。
=4,解得x=0.3,则CO的转化率为0.3÷0.5×100%=60%。②该反应的气体是由CO转化为CO2,故气体的质量增加,容器体积不变,故气体密度为变化量,当气体的密度不变时,说明反应已达到平衡状态,a项正确;Fe2O3为固体,增加其用量不会影响平衡,b项错误;该反应中的反应物和生成物中气体只有一种,故尽管乙容器中的CO用量增加,但不会影响转化率,c项错误;将甲、乙中CO2的物质的量进行极端转换,得起始时CO气体的物质的量之比为2∶3,则平衡时CO物质的量浓度之比为2∶3,d项正确。
(4)①a装置中铁连接电源的正极,为阳极,发生氧化反应,加速其腐蚀,a错误;b装置中铁连接电源的负极,为阴极,能保护铁不被腐蚀,是外接电源的阴极保护法,b正确;c装置中,锌比铁活泼,锌作负极,铁被保护,是牺牲阳极的阴极保护法,c正确。
②若d装置能够保护铁,则X的活泼性应比铁活泼,使右侧装置为原电池,左侧装置为电解池,构成外接电源的阴极保护法,X可以是Zn、Al等活泼的金属。
(5)根据Ksp计算公式可得:
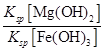 =
=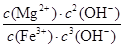 ,
,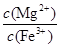 =
=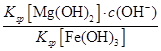 =
=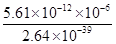 =2.125×1021。
=2.125×1021。
练习册系列答案
相关题目
 HOI(aq) △H2
HOI(aq) △H2
 4OH-
4OH- O2(g)
O2(g) CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。




 N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
 2NO(g)
2NO(g)  H>0
H>0