题目内容
下列分析正确的是( )
| A.将氯气通入H2O2和NaOH的混合溶液中,发出红光,说明反应物的总能量低于生成物的总能量,放出热量 |
| B.1mol H2在氯气中完全燃烧,放出180kJ热量,则键能(E)的关系为E(H—H)=180kJ+2E(H—Cl)-E(Cl—Cl) |
| C.干燥的碘粉与铝粉混合无明显现象,滴上一滴水会冉冉升起紫色的碘蒸气,最后得到白色AlI3。说明碘和铝发生的反应是放热反应 |
| D.精确实验测得H2O在常温下也能微弱电离:H2O??H++OH-,该过程是放热过程 |
C
A项,反应物的总能量应该高于生成物的总能量;B项,正确的关系式是E(H—H)=2E(H—Cl)-E(Cl—Cl)-180kJ,注意是键能和能量的关系;D项,电离是吸热的。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1 、CO2占
、CO2占 ,且C(s)+
,且C(s)+ O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+ CH3OH(g)。
CH3OH(g)。 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。 CO2(g) + H2(g)
CO2(g) + H2(g)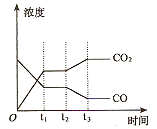
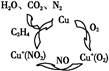
 O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
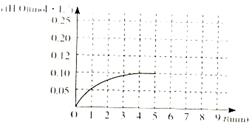
O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。 CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。