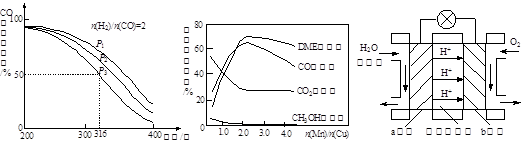题目内容
(1)已知: C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= ____ ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。

③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.25" mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= ____ ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH
CH3OH(g) ΔH①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。

③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.25" mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(1)-524.8(2分)
(2)①c(2分);② =(2分);<(2分);③75%(3分); 1.3(2分)
(3)O2+4e-+2CO2=2CO32-(2分)
(2)①c(2分);② =(2分);<(2分);③75%(3分); 1.3(2分)
(3)O2+4e-+2CO2=2CO32-(2分)
试题分析: (1)根据盖斯定律和已知方程式可得,ΔH=ΔH1-ΔH2 =-393.5 kJ/mol-131.3 kJ/mol="-524.8" kJ/mol。
(2)①A项每消耗1 mol CO的同时生成2molH2 表示的是正逆反应速率相等,所以反应达到平衡。
B.根据反应方程式中气体系数可知,该反应是前后气体的减少的反应,所以混合气体总物质的量不变时,反应达到平衡,B正确;
C.生成CH3OH的速率与消耗CO的速率均表示正反应速率,不能说明反应达平衡,C错误;
D.反应中各物质的浓度不再变化是化学反应达到平衡的重要标志,D正确。
②反应的平衡常数只与温度有关,所以图像中A、B的温度相等,所以平衡常数也相等,即K(A)= K(B);又可看出图像曲线随着温度升高,CO的转化率不断降低,所以温度升高对正反应不利,使平衡逆向移动,所以该反应的正反应是一个放热反应,ΔH <0。
③ CO(g) + 2H2(g)
 CH3OH(g)
CH3OH(g)初始浓度(mol/L):1 3 0
转化浓度(mol/L):0.75 2.25 0.75
平衡浓度(mol/L):0.25 0.75 0.75
所以H2的转化率=0.75÷1×100%=75%
平衡常数K= c(CH3OH) / c(CO)c2(H2) ="0.75/" 0.752 0.25=1.3
(3)该电池的反应原理实质是用水煤气做燃料,制成一个燃料电池,所以电池总反应式就是水煤气的燃烧反应CO+H2 +O2=CO2+H2O,可以看出Li2CO3和Na2CO3只是做电解质并没有发生反应,所以根据已知得负极反应式消耗CO32-可推得正极反应式应生成CO32-,所以可得正极反应式为O2+4e-+2CO2=2CO32- 。

练习册系列答案
相关题目
 CH3OH(g)。
CH3OH(g)。 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
 HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
 CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
 N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下: CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1