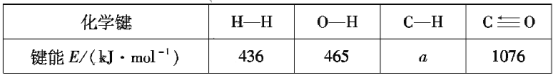
题目内容
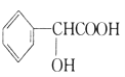
【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
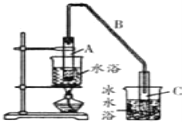
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
【答案】防暴沸 冷凝 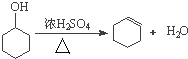 冷却,减少环己烯挥发 下 c 除去环己烯中混有的少量水 83℃ b
冷却,减少环己烯挥发 下 c 除去环己烯中混有的少量水 83℃ b
【解析】
在试管A中先后加入12.5mL环已醇、1mL浓硫酸,为防暴沸,放入几片碎瓷片,缓缓加热,环己醇在浓硫酸的作用下发生消去反应生成环己烯,产生的环己烯易挥发,用长导管导蒸汽兼冷凝得液态环己烯,再用冰水浴冷却以减少环己烯挥发。
(1)①加碎瓷片以防暴沸,长导管的作用是导气兼冷凝,故答案为:防暴沸;冷凝;
②环已醇在浓硫酸作用下发生消去反应得到环己烯,反应方程式为: ,故答案为:
,故答案为: ;
;
③环己烯沸点低,易挥发,冰水浴的作用是:冷却,减少环己烯挥发,故答案为:冷却,减少环己烯挥发;
(2)①环己烯的密度比水小,水在下层,因混有酸液,洗涤环己烯粗品的试剂作如下
a.酸性高锰酸钾溶液能氧化环己烯,故不能用KMnO4洗涤,a错误;
b.稀硫酸不能除去混有的酸液,不能用稀硫酸洗涤,b错误;
c.酸液可和Na2CO3溶液反应而除去,故可用Na2CO3溶液洗涤,c正确;
故答案为:下;c;
②生石灰能与水反应生成氢氧化钙而将水除去,所以,蒸馏时加入生石灰的目的是除去环己烯中混有的少量水,故答案为:除去环己烯中混有的少量水;
③蒸馏时,应该控制蒸汽的温度在沸点温度,即83℃,故答案为:83℃;
(3)a.环己烯能和酸性高锰酸钾溶液反应,环已烯精品和粗品都能使酸性高锰酸钾溶液褪色,a不能区分;
b.环己烯粗品中含环己醇,环己醇含羟基,可和金属钠反应放出氢气,而环己烯精品不含环己醇,不能和金属钠反应放出氢气,b能区分;
c.环己烯含碳碳双键,环已烯精品和粗品都能和溴水反应使溴水褪色,c不能区分;
故答案为:b。

 名校课堂系列答案
名校课堂系列答案