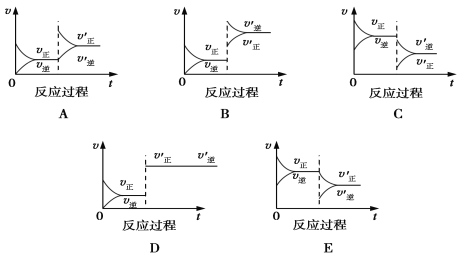
题目内容
【题目】A、B、C 为短周期元素,它们的位置关系如图所示,已知 B、C 两元素原子核内质子数之和是 A 元素的原子核内质子数的 4 倍。

(1)写出 A、B 的元素符号:A____、B____。
(2)B 在周期表中的位置为____,C 的离子结构示意图为____。
(3)A 的氢化物的分子式为____;B、C 的最高价氧化物对应的水化物的分子式分别为____、____。
【答案】O P 第三周期VA族 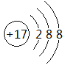 H2O或H2O2 H3PO4 HClO4
H2O或H2O2 H3PO4 HClO4
【解析】
根据题给图表,设A元素原子序数为z,则B的原子序数为z+7,C的原子序数为z+9,据题意有:4z= z+7+ z+9,z=8,所以A为氧;B的原子序数为8+7=15,为磷;C的原子序数为8+9=17,为氯。可在此基础上解各小题。
(1)根据分析,A、B分别为氧、磷,元素符号分别为O、P。答案为:O;P;
(2)B为P,在周期表中的位置为第三周期VA族;C为Cl,Cl- 结构示意图为 。答案为:第三周期VA族;
。答案为:第三周期VA族; ;
;
(3)A为O,O的氢化物的分子式为H2O或H2O2;P、Cl分别为VA族、VIIA族,最高价分别是+5、+7,所以,B(P)、C(Cl) 的最高价氧化物对应的水化物的分子式分别为H3PO4、HClO4。答案为:H2O或H2O2;H3PO4;HClO4。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目