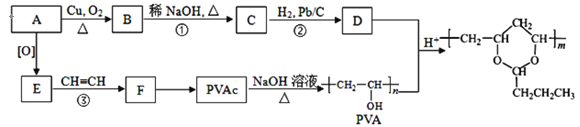
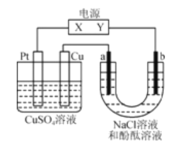
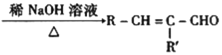题目内容
【题目】(1)Fe(OH)3胶体的制备方法为:将_____________逐滴滴入_______中,继续加热煮沸,直至分散系呈现______。判断是否有胶体生成的方法是利用_______效应。
(2)硫化氢气体通入浓硫酸中发生反应:H2S + H2SO4(浓) === S↓ + SO2↑ + 2H2O
用单线桥法表示电子转移的方向和数目________________________,该反应的还原产物是_______________。
【答案】饱和FeCl3 沸水 红褐色 丁达尔 ![]() SO2
SO2
【解析】
(1)根据实验室制备氢氧化铁胶体飞方法和胶体的性质分析解答;
(2)根据化合价变化,结合氧化还原反应的规律分析解答。
(1)实验室制备氢氧化铁的方法为:在沸腾的蒸馏水中加入饱和氯化铁溶液,继续加热煮沸,直至分散系呈现透明的红褐色;当可见光通过胶体分散系时,从侧面观察到一条光亮的“通路”,丁达尔效应是胶体的特性,可以用来判断胶体的存在,故答案为:饱和FeCl3;沸水;红褐色;丁达尔;
(2)H2S + H2SO4(浓) === S↓ + SO2↑ + 2H2O反应中H2S中-2价的硫失去2个电子,化合价升高到0价,所以H2S为还原剂,S为氧化产物;H2SO4(浓)中+6价的硫得到2个电子化合降低到SO2↑+中的+4价的硫,所以H2SO4(浓)为氧化剂,二氧化硫为还原产物,反应中转移2mol电子,所以用单线桥表示为:![]() ,故答案为:
,故答案为:![]() ;SO2。
;SO2。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______(填元素名称)。
(2)以上元素中,属于s区的元素有_____种,属于d区的元素有______种。
(3)第一电离能I1(Cr)________I1(Co)(填“>”、“<”或“=”,下同)。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。