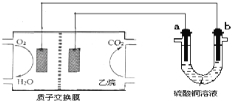
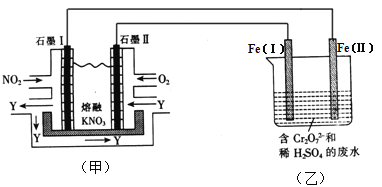
题目内容
【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
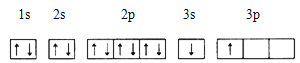
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
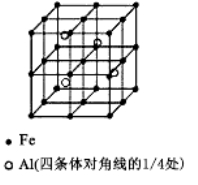
①确定该合金的化学式 。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
【答案】(1)①能量最低原理;s ;②sp杂化;直线形;
(2)①8;②![]() ;③B;
;③B;
(3)①Fe2Al;②![]() 。
。
【解析】
试题分析:A:I3》I2,说明最外层只有2个电子数,位于第IIA族元素,B:I3》I2,说明最外层有2个电子,位于第IIIA族元素,
(1)①根据构造原理,排满一个能级排一个能级,s能级上最多排2个电子,因此B的排布式违背了能量最低原理;B的最后一个电子填充在s能级上,因此属于s区;②ACl2中含有2个σ键,无孤电子对,因此价层电子对数为2,杂化类型为sp,空间构型为直线型;
(2)①Fe的晶胞是体心立方堆积,配位数为8;②等电子体:原子总数相等、价电子总数相等的分子或离子,即为N2,其电子式为:![]() ;③含有配位键、共价键、σ键,C和N之间共用叁键,含有π键,故选项B正确;
;③含有配位键、共价键、σ键,C和N之间共用叁键,含有π键,故选项B正确;
(3)Fe的个数:8×1/8+1+6×1/2+12×1/4=8,Al位于体心,个数为4,因此化学式为Fe2Al;②设两个最近的Fe的距离为a,晶胞的体积为(2a)3,晶胞的质量为8×139/2NA,根据密度的定义,因此a=![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol 2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol 2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
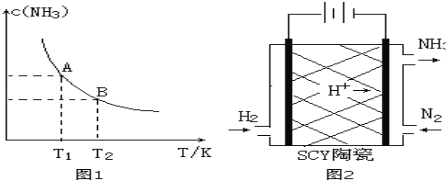
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________ ___;
制铝时,电解Al2O3而不电解AlCl3的原因是____________________________ __。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料,SiCl4(熔点-70 ℃)。由粗硅制纯硅过程如下:
![]()
SiCl4属于 晶体。在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________________________ 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3b.HI c.SO2d.CO2