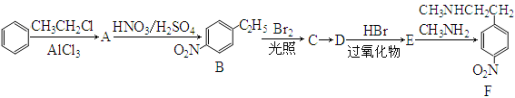
题目内容
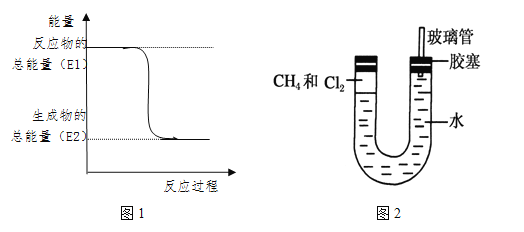
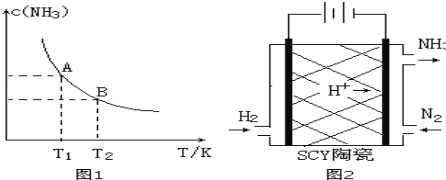
【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol 2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol 2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
【答案】(1)①>,<;②8.00×10﹣3mol/(Lmin);③K1≈18.3 (L/mol)2;
(2)>;(2a﹣3b)kJ/mol;
(3)N2+6e﹣+6H+=2NH3;
(4)① 碱 ;由于NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性;② BE。
【解析】
试题分析:(1)①随着温度升高,c(NH3)减小,说明平衡向逆反应方向移动,平衡常数减小,K1>K2;根据勒夏特列原理,△H<0;②N2 + 3H2 ![]() 2NH3
2NH3
起始:1 3 0
变化:x 3x 2x
平衡:(1-x) (3-3x) 2x 2x/(4-2x)×100%=25%,解得:x=0.4,v(N2)=0.4/(10×5)mol/(L·min)=0.008 mol/(L·min);③根据化学平衡常数的定义,代入化学平衡常数的表达式,K1=18.3;(2)反应后气体系数之和大于反应前气体系数,因此是熵增,即△S>0,N2(g)+3H2(g)=2NH3(g) ①,2H2(g)+O2(g)=2H2O(l) ②,因此有2×①-3×②得出:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=(2a-3b)kJ·mol-1;(3)根据实验原理示意图,阴极是电极跟电源的负极相连,右侧电极为阴极,因此电极反应式为N2+6H++6e-=2NH3;(4)①根据两者电离平衡常数比较,NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-的水解程度大于NH4+水解程度,因此溶液显碱性;②A、CO32-的水解程度大于NH4+的水解程度,因此离子浓度:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O),故说法正确;B、根据溶液呈现电中性,c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故说法错误;C、根据物料守恒,故说法正确;D、根据物料守恒,故说法正确;E、利用水电离产生c(H+)=c(OH-),c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)+c(NH3·H2O),故说法错误。

 阅读快车系列答案
阅读快车系列答案【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
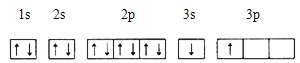
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
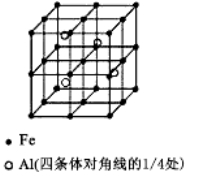
①确定该合金的化学式 。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。