题目内容
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

(1)A分子中官能团的名称是 ,D中官能团的名称是________反应①的反应类型是 反应。
(2)反应②的化学方程式是 。
反应④的化学方程式是 。
(3)E是常见的高分子材料,合成E的化学方程式是 。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

① 实验开始时,试管甲中的导管不伸入液面下的原因是 。
②上述实验中饱和碳酸钠溶液的作用是(填字母) 。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,__________(能/不能)生成1mol 乙酸乙酯,原因是 。
【答案】(1)碳碳双键,羧基,加成反应。
(2)2CH3CH2OH + O2 ![]() 2CH3CHO + 2H2O;
2CH3CHO + 2H2O;
CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O。
CH3COOCH2CH3 + H2O。
(3)n CH2=CH2 ![]()
![]() 。
。
(4)①防止倒吸。②BC。③不能,该反应为可逆反应,有一定的限度,不可能完全转化。
【解析】
试题分析:根据题给信息和转化关系推断,A为CH2=CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,E为![]() ,据此作答。
,据此作答。
(1)A为CH2=CH2,分子中官能团的名称是碳碳双键,D为CH3COOH,官能团的名称是羧基,反应①为乙烯和水发生加成反应生成乙醇,反应类型是加成反应。
(2)反应②为乙醇在催化剂加热的条件下与氧气反应生成乙醛和水,化学方程式是2CH3CH2OH + O2 ![]() 2CH3CHO + 2H2O;反应④为乙醇和乙酸在浓硫酸加热的条件下反应乙酸乙酯和水,化学方程式是CH3COOH + CH3CH2OH
2CH3CHO + 2H2O;反应④为乙醇和乙酸在浓硫酸加热的条件下反应乙酸乙酯和水,化学方程式是CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O。
CH3COOCH2CH3 + H2O。
(3)乙烯在引发剂存在的情况下发生加聚反应生成聚乙烯,化学方程式是n CH2=CH2 ![]()
![]() 。
。
(4)① 该实验过程中挥发出乙酸和乙醇蒸气易溶于水,实验开始时,试管甲中的导管不伸入液面下的原因是防止倒吸。
②上述实验中饱和碳酸钠溶液的作用是中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,有利于分层析出,选BC。
③在实验室利用乙醇和乙酸制备乙酸乙酯的反应为可逆反应,故用1mol 乙醇和1mol 乙酸充分反应,不能生成1mol 乙酸乙酯。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
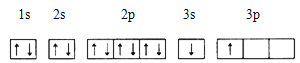
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
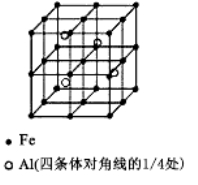
①确定该合金的化学式 。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
【题目】短周期元求X、Y、W在元素周期表中的相对位置如下图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X | ||||||
Y | Z | W |
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W>X
C.简单离子半径的大小顺序:r(Y+)>r(X-)
D.Y、W的最高价氧化物的水化物均能溶解金厲Z