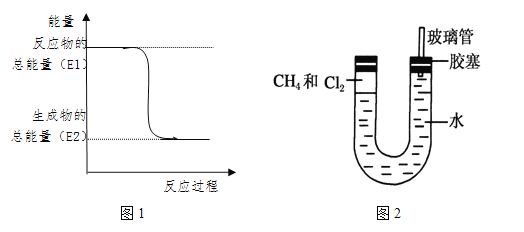
题目内容
【题目】下表是元素周期表的一部分,请用化学用语回答:

(1)最高价氧化物对应的水化物中酸性最强的是 。
(2)实验室制取②的氢化物的化学方程式 。
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式 。
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有 ,其电子式为
【答案】(1)HClO4;(2)2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O。
CaCl2+ 2NH3↑+ 2H2O。
(3)Al(OH)3+NaOH=NaAlO2+2H2O。
(4)共价键,![]() 。
。
【解析】试题分析:(1)最高价氧化物对应的水化物中酸性最强的是HClO4。
(2)②为氮元素,实验室利用氯化铵和氢氧化钙共热生成氨气、氯化钙和水,化学方程式为2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O。
CaCl2+ 2NH3↑+ 2H2O。
(3)④为钠元素,⑤为铝元素,氢氧化钠与氢氧化铝反应生成偏铝酸钠和水,化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。
(4)②为氮元素,⑥为氯元素,HClO中含有的化学键类型为共价键,其电子式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
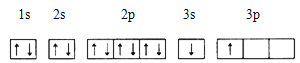
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
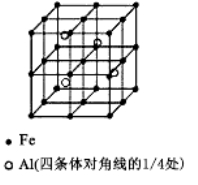
①确定该合金的化学式 。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
【题目】短周期元求X、Y、W在元素周期表中的相对位置如下图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X | ||||||
Y | Z | W |
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W>X
C.简单离子半径的大小顺序:r(Y+)>r(X-)
D.Y、W的最高价氧化物的水化物均能溶解金厲Z