题目内容
【题目】弱电解质有许多如:醋酸、碳酸、氢氰酸、一水合氨等,已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表
氢氰酸 | 碳酸 | 醋酸 |
Ka=6.2×10-10 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为____(填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_________。
(3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,则混合溶液中c(H+) _____c(OH-)(用 < > = 填空)
(4)常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
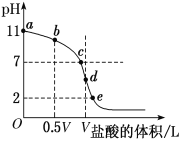
①该温度时NH3·H2O的电离常数K=______。
②比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为________。
③滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是________(填字母,下同)。
A.c(H+)·c(OH-) B. ![]()
C. 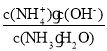 D.
D. ![]()
④根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH![]() 和NH3·H2O两种形式)。
和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
【答案】①>③>② CN-+CO2+H2O=HCN+HCO![]() < 10-5 d>c>b ACD D
< 10-5 d>c>b ACD D
【解析】
(1)醋酸电离常数大于氢氰酸大于碳酸氢根离子,电离常数越大,酸性越强;根据越弱越水解进行判断;
(2) 向NaCN溶液中通入少量CO2,H2CO3酸性大于HCN大于HCO![]() ,所以反应生成氰酸和碳酸氢钠;
,所以反应生成氰酸和碳酸氢钠;
(3)等体积混合浓度减半,溶液中的溶质是物质的量浓度均为0.005mol/L的NaCN和HCN;
(4)①滴定前氨水中c(H+)=10-11mol/L,利用水的离子积常数求氢氧根离子的浓度,再求一水合氨的电离平衡常数;
②在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;在c点时,溶质为氨水和氯化铵,氨水的电离程度等于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响;在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进;
③A.温度不变,水的离子积常数不变;
B.由b点到c点加酸的过程中,c(H+)增大,c(OH-)不断减小;
C. 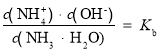 ,温度不变,电离平衡常数不变;
,温度不变,电离平衡常数不变;
D. ![]() ,温度不变,该比值也不变;
,温度不变,该比值也不变;
④A.点b反应后溶液是NH4Cl与NH3·H2O物质的量之比为1:1的混合物,溶液呈碱性,结合三大守恒判断;
B.点c时pH=7,即c(OH-)=c(H+),由电荷守恒判断;
C.点d恰好完全反应生成NH4Cl,NH4Cl水解溶液呈酸性;
D.当NH3·H2O较多,滴入的HCl较少时,生成NH4Cl少量,溶液中NH3·H2O浓度远大于NH4Cl浓度;
(1)依据图表数据分析,醋酸电离常数大于氢氰酸大于碳酸氢根离子,所以pH相等的三种溶液:①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,水解程度相同,且越弱越水解,则浓度由大到小的顺序为:①>③>②,故答案为:①>③>②;
(2) 向NaCN溶液中通入少量CO2,H2CO3酸性大于HCN大于HCO![]() ,所以反应生成氰酸和碳酸氢钠,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,其反应的离子方程式为: CN-+CO2+H2O=HCN+HCO
,所以反应生成氰酸和碳酸氢钠,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,其反应的离子方程式为: CN-+CO2+H2O=HCN+HCO![]() ,故答案为:CN-+CO2+H2O=HCN+HCO
,故答案为:CN-+CO2+H2O=HCN+HCO![]() ;
;
(3) 将0.02mol/L的HCN与0.01mol/L的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度均为0.005mol/L的NaCN和HCN,则c(Na+)>c(CN-),根据电荷守恒可知:c(H+)<c(OH-),故答案为:<;
(4)①滴定前氨水中c(H+)=10-11mol/L,利用水的离子积常数可得:![]() ,一水合氨的电离平衡常数:
,一水合氨的电离平衡常数: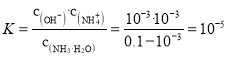 ,故答案为:10-5;
,故答案为:10-5;
②在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;在c点时,溶质为氨水和氯化铵,氨水的电离程度等于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响;在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进;所以b、c、d三点时的溶液中,水电离的c(H+)大小顺序是d>c>b,故答案为:d>c>b;
③A.温度不变,水的离子积常数不变,所以c(
B.由b点到c点加酸的过程中,c(H+)增大,c(OH-)不断减小,故![]() 增大,B错误;
增大,B错误;
C. 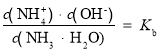 ,温度不变,电离平衡常数不变,C正确;
,温度不变,电离平衡常数不变,C正确;
D. ![]() ,温度不变,该比值也不变,D正确;故答案为:ACD;
,温度不变,该比值也不变,D正确;故答案为:ACD;
④A.由图象可知,点b反应后溶液是NH4Cl与NH3·H2O物质的量之比为1:1的混合物,溶液呈碱性,说NH3·H2O的电离程度大于NH4Cl的水解程度,由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:2c(C1-)=c(NH4+)+c(NH3·H2O),质子守恒为:2c(OH-)+c(NH3·H2O)=c(NH4+)+2c(H+);A错误;
B.点c时pH=7,即c(OH-)=c(H+),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),故c(NH4+)=c(C1-)>c(OH-)=c(H+),B错误;
C.点d恰好完全反应生成NH4Cl,NH4Cl水解溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-),C错误;
D.当NH3·H2O较多,滴入的HCl较少时,生成NH4Cl少量,溶液中NH3·H2O浓度远大于NH4Cl浓度,可能出现c(NH3H2O)>c(NH4+)>c(OH-)>c(C1-)>c(H+),D正确;故答案为:D。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为______;该温度下反应的平衡常数为______。
(4)850℃时,以下表中不同的起始浓度在体积可变的密闭容器中进行反应,其CO平衡转化率与原平衡相同的是______(选填a、b、c、d)。
c(CO) | c(H2O) | c(H2) | c(CO2) | |
a | 2 | 1 | 1 | 1 |
b | 0.6 | 0.4 | 0 | 0 |
c | 0.2 | 0 | 0.1 | 0.1 |
d | 1 | 1 | 1 | 1 |
(5)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示
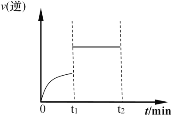
则t1时改变的某种反应条件可能是_____(填序号)。
a.增大CO浓度 b.加压
c.恒容时充入氩气 d.使用催化剂
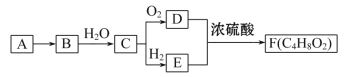
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
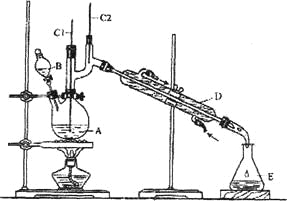
发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)上述装置图中,B仪器的名称是__________,D仪器的名称是__________;
(2)加入沸石的作用是__________;
(3)分液漏斗使用前必须进行的操作是__________ (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在__________层(填“上”或“下”);
(5)反应温度应保持在90~95℃。其原因是______________________________;
(6)本实验中,正丁醛的产率为__________%。
【题目】(1)某元素的全部电离能(单位:eV)如下:
I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式_______________。
(2)分子中的大π 键可用符号![]() 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为![]() 。
。
①试判断 SO2 最外层一共有_______________对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________,N![]() 中的大π 键应表示为_______________。
中的大π 键应表示为_______________。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________。