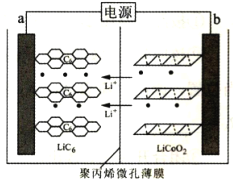
题目内容
【题目】(1)某元素的全部电离能(单位:eV)如下:
I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式_______________。
(2)分子中的大π 键可用符号![]() 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为![]() 。
。
①试判断 SO2 最外层一共有_______________对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________,N![]() 中的大π 键应表示为_______________。
中的大π 键应表示为_______________。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________。
【答案】![]() 5 180° (2 个) π
5 180° (2 个) π![]() Be(OH)2+2OH- = BeO
Be(OH)2+2OH- = BeO![]() +2H2O
+2H2O
【解析】
根据表格数据分析,该元素第六电离能与第七电离能差距增大;HN3称为叠氮酸是分子晶体,N3-中含有3个原子,电子数为22;氢氧化铝为两性氢氧化物。
(1)根据表格数据,I6和I7电离能差距突然加大,该元素最外层电子数为6,则该元素价电子轨道表示式为![]() 。
。
(2)①SO2中存在一个三中心4电子的大π键,电子式为![]() ,由电子式可知 SO2 最外层一共有5对孤对电子。
,由电子式可知 SO2 最外层一共有5对孤对电子。
②N3-中含有3个原子,共22个电子,与CO2互为等电子体,结构相似,所以N3-为直线形,键角为180°,N![]() 的电子式为
的电子式为![]() ,3个氮原子形成两个大 π 键,形成大π 键的电子数为4,故其大π 键应表示为(2 个)π
,3个氮原子形成两个大 π 键,形成大π 键的电子数为4,故其大π 键应表示为(2 个)π![]() 。
。
(3) Be、Al 的化学性质相似,氢氧化铝为两性氢氧化物,则Be(OH)2也为两性氢氧化物,与 NaOH 反应的离子方程为Be(OH)2+2OH- = BeO![]() +2H2O。
+2H2O。

【题目】弱电解质有许多如:醋酸、碳酸、氢氰酸、一水合氨等,已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表
氢氰酸 | 碳酸 | 醋酸 |
Ka=6.2×10-10 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为____(填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_________。
(3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,则混合溶液中c(H+) _____c(OH-)(用 < > = 填空)
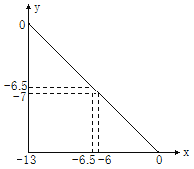
(4)常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
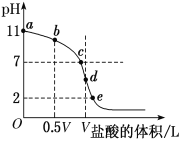
①该温度时NH3·H2O的电离常数K=______。
②比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为________。
③滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是________(填字母,下同)。
A.c(H+)·c(OH-) B. ![]()
C.  D.
D. ![]()
④根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH![]() 和NH3·H2O两种形式)。
和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内,ν(Q)=0.075mol·L-1·min-1,ν(Z)∶ν(Y)=1∶2。
(1)方程式中m=______,n=______,p=______,q=______。
(2)2.5min内,Q的转化率为______________。
(3)对于该反应,能增大正反应速率的措施是___________
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度
(4)该反应达到化学平衡状态时___________
A.容器内气体压强保持不变 B.容器内气体密度保持不变
C.容器内气体平均摩尔质量保持不变 D.正反应速率与逆反应速率相等