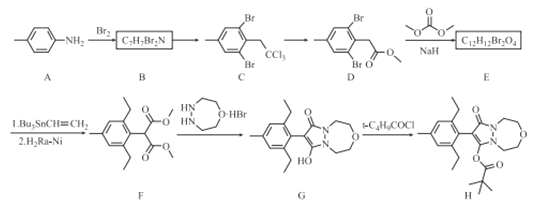
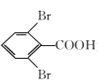
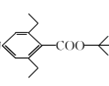
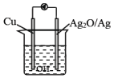
题目内容
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,以C表示的平均速率v(C)=0.25 mol·L-1·min-1,下列说法正确的是( )
A. 该反应方程式中,x=1 B. 2 min时,A的物质的量为0.75 mol
C. 2 min时,A的转化率为50% D. 反应速率v(B)=0.25 mol·L-1·min-1
【答案】C
【解析】2min后测得D的浓度为0.5 mol·L-1,v(D)=![]() =0.25 mol·L-1·min-1,B表示的平均速率v(C)=0.25 mol·L-1·min-1,由速率之比等于化学计量数之比可以知道,x=2,设A、B的起始物质的量均为n,生成D为2L×0.5 mol·L-1=1mol,则
=0.25 mol·L-1·min-1,B表示的平均速率v(C)=0.25 mol·L-1·min-1,由速率之比等于化学计量数之比可以知道,x=2,设A、B的起始物质的量均为n,生成D为2L×0.5 mol·L-1=1mol,则
3A(g)+B(g)2C(g)+2D(g)
起始 n n 0 0
转化 1.5 0.5 1 1
2minn-1.5 n-0.5 1 1
c(A)∶c(B)=3∶5,则![]() =
=![]() ,计算得出n=3,以此来解答。
,计算得出n=3,以此来解答。
详解: A.由上述分析可以知道,x=2,故A错误;
B. 2min时,A的物质的量为3mol-1.5mol=1.5mol,故B错误;
C.2 min时,A的转化率为![]() ×100%=50%,所以C选项是正确的;
×100%=50%,所以C选项是正确的;
D. 反应速率v(B)=![]() =0.125 mol·L-1·min-1,故D错误;
=0.125 mol·L-1·min-1,故D错误;
所以C选项是正确的。

 阅读快车系列答案
阅读快车系列答案【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)