��Ŀ����
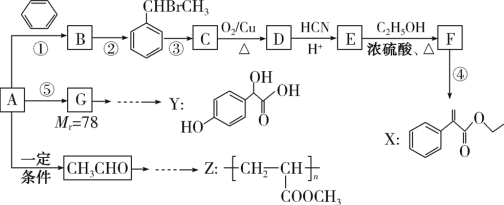
����Ŀ��CO�������ʻ���ѧƷ�Ļ���ԭ�ϣ� 850��ʱ���ں����ܱ�������ͨ��CO��H2O(g)��������CO(g)��H2O(g) ![]() H2(g)��CO2(g)
H2(g)��CO2(g) ![]() H��0���ⶨŨ����ʱ���ϵ���±���
H��0���ⶨŨ����ʱ���ϵ���±���
t/min | c(CO)/ mol��L��1 | c(H2O)/ mol��L��1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
�ش���������
��1��t=3minʱ����(��)____________��(��)��ѡ���������������������������
��2��0��2min��CO��ƽ����Ӧ����Ϊ ____________��
��3��������Ӧ�е�COƽ��ת����Ϊ______�����¶��·�Ӧ��ƽ�ⳣ��Ϊ______��
��4��850��ʱ�����±��в�ͬ����ʼŨ��������ɱ���ܱ������н��з�Ӧ����COƽ��ת������ԭƽ����ͬ����______��ѡ��a��b��c��d����
c(CO) | c(H2O) | c(H2) | c(CO2) | |
a | 2 | 1 | 1 | 1 |
b | 0.6 | 0.4 | 0 | 0 |
c | 0.2 | 0 | 0.1 | 0.1 |
d | 1 | 1 | 1 | 1 |
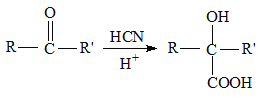
��5����һ�������£��������з�Ӧ��CO(g)��H2O(g) ![]() H2(g)��CO2(g)�����淴Ӧ��������ʱ��仯������ͼ��ʾ
H2(g)��CO2(g)�����淴Ӧ��������ʱ��仯������ͼ��ʾ
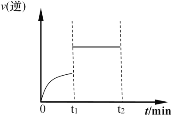
��t1ʱ�ı��ij�ַ�Ӧ����������_____������ţ���
a������COŨ�� b����ѹ
c������ʱ������� d��ʹ�ô���
���𰸡��� ![]() 40% 1 b bd
40% 1 b bd
��������
(1) t=3minʱ����CO��Ũ�ȿɼ����ˮ������Ũ�ȣ�
(2) 0��2min��CO��ת��Ũ�ȵ���ˮ������ת��Ũ�ȣ�
(3)��3min�Ѵﵽƽ�⣬ƽ��ʱ��CO��Ũ��Ϊ0.18mol��L-1��ˮ������Ũ��Ϊ0.08 mol��L-1�������Ͷ�����̼��Ũ��Ϊ0.12 mol��L-1��
(4)ֻҪ��ʼʱ c ��CO����c ��H 2O��=3��2��ƽ��ʱCO��ת���ʼ���ȣ���
(5)t 1ʱ�̸ı��������淴Ӧ����˲ʱ�ӿ죬�����Ϊ��ѹ��ʹ�ô�����
(1) t=3minʱ����CO��Ũ�ȿɼ����ˮ������Ũ��Ϊ0.08mol/L���ٷ���4minʱ��ˮ������Ũ��Ϊ0.08mol/L����֪3minʱ��Ӧ�Ѵﵽƽ�⣬�������淴Ӧ������ȣ��ʴ�Ϊ��=��
(2) 0��2min��CO��ת��Ũ�ȵ���ˮ������ת��Ũ�ȣ�Ϊ0.1mol/L����COƽ����Ӧ����Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)3min�Ѵﵽƽ�⣬CO��ת����Ϊ��![]() ����ƽ��ʱ��CO��Ũ��Ϊ0.18mol��L-1��ˮ������Ũ��Ϊ0.08 mol��L-1�������Ͷ�����̼��Ũ��Ϊ0.12 mol��L-1������¶���ƽ�ⳣ��Ϊ��
����ƽ��ʱ��CO��Ũ��Ϊ0.18mol��L-1��ˮ������Ũ��Ϊ0.08 mol��L-1�������Ͷ�����̼��Ũ��Ϊ0.12 mol��L-1������¶���ƽ�ⳣ��Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��1��
��1��
(4)�ɱ��������֪��ֻҪ��ʼʱ c ��CO����c ��H 2O��=3��2��ƽ��ʱCO��ת���ʼ���ȣ�a��Ȼ��ԭƽ���Ч����CO��ת���ʲ��ȣ�b��ʼŨ�ȷ��� c ��CO����c ��H 2O��=3��2��CO��ת������ȣ�c��d��ԭƽ�ⲻ��Ч���ʴ�Ϊ��b��
(5)t 1ʱ�̸ı��������淴Ӧ����˲ʱ�ӿ죬�����Ϊ��ѹ��ʹ�ô���������CO��Ũ�ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʲ�����˲ʱ�ӿ죻����ʱ����Ar�������и���ֵ�Ũ�Ȳ��䣬��Ӧ���ʲ��䣬�ʴ�Ϊ��bd��

����Ŀ����������������磺���ᡢ̼�ᡢ�����ᡢһˮ�ϰ��ȣ���֪25��ʱ�����ᡢ̼�ᡢ������ĵ���ƽ�ⳣ�����±�
������ | ̼�� | ���� |
Ka=6.2��10-10 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=1.7��10-5 |
��1��25��ʱ��pH��ȵ�������Һ��CH3COONa��Һ����Na2CO3��Һ����NaCN��Һ��Ũ���ɴ�С��˳��Ϊ____(�����)��
��2��25��ʱ����NaCN��Һ��ͨ������CO2����Ӧ�����ӷ���ʽΪ_________��
��3����Ũ��Ϊ0.02mol/L��HCN ��0.01mol/LNaOH ��Һ�������ϣ�������Һ��c(H+) _____c(OH-)���� < > = ��գ�
��4�������£���Ũ��Ϊ0.1 mol��L��1�����ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ���Һ��pH������ļ����������͵ĵζ����ߣ�d��������Һǡ����ȫ��Ӧ������ͼ����Ϣ�ش��������⣺
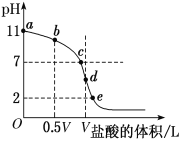
�ٸ��¶�ʱNH3��H2O�ĵ��볣��K��______��
�ڱȽ�b��c��d����ʱ����Һ�У���ˮ�������c(H��)�ɴ�С˳��Ϊ________��
�۵ζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ���ֲ������________(����ĸ����ͬ)��
A��c(H��)��c(OH-) B. ![]()
C. 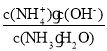 D.
D. ![]()
�ܸ������ϵζ������ж�����˵����ȷ����________(��Һ��NԪ��ֻ����NH![]() ��NH3��H2O������ʽ)��
��NH3��H2O������ʽ)��
A����b��ʾ��Һ�У�c(NH![]() )��c(H��)��c(OH��)��c(NH3��H2O)
)��c(H��)��c(OH��)��c(NH3��H2O)
B����c��ʾ��Һ�У�c(Cl��)��c(NH3��H2O)��c(NH![]() )
)
C����d��ʾ��Һ�У�c(Cl��)>c(H��)>c(NH![]() )>c(OH��)
)>c(OH��)
D���ζ������п����У�c(NH3��H2O)>c(NH![]() )>c(OH��)>c(Cl��)>c(H��)
)>c(OH��)>c(Cl��)>c(H��)
����Ŀ����2L�ܱ������н��з�Ӧ��mX(g)��nY(g)![]() pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
���� | X | Y | Z | Q |
��ʼ/mol | 0.7 | 1 | ||
2minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3minĩ/mol | 0.8 |
��֪��2min�ڣ���(Q)��0.075mol��L��1��min��1����(Z)�æ�(Y)��1��2��
��1������ʽ��m��______��n��______��p��______��q��______��
��2��2.5min�ڣ�Q��ת����Ϊ______________��
��3�����ڸ÷�Ӧ������������Ӧ���ʵĴ�ʩ��___________
A������������� B�����߲���Q C��ͨ�����X D�������¶�
��4���÷�Ӧ�ﵽ��ѧƽ��״̬ʱ___________
A������������ѹǿ���ֲ��� B�������������ܶȱ��ֲ���
C������������ƽ��Ħ���������ֲ��� D������Ӧ�������淴Ӧ�������