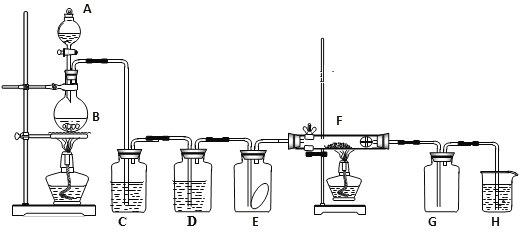
题目内容
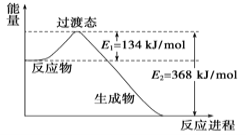
【题目】短周期主族元素 A、B、C、D 的原子序数依次增大,A、B、C 原子的最外层电子数之和为 12,B、C、D 位于同一周期,C 原子的最外层电子数既是 A 原子内层电子数的 3 倍又是 B 原子最外层电子数的 3 倍。下列说法正确的是( )
A.元素 A、C 的最高价氧化物对应的水化物的酸性:A>C
B.元素B 能与 A 的最高价氧化物发生置换反应
C.AC2 空间构型为角形
D.C2D2 是共价化合物,且为直线型非极性分子
【答案】B
【解析】
根据题意,C原子的最外层电子数是A原子内层电子数的3倍,A原子内层电子数只能是2,则C的最外层电子数为6,C原子的最外层电子数是B原子最外层电子数的3倍,B的最外层电子数为2,A、B、C原子的最外层电子数之和为12, A的最外层电子数为12-2-6=4,则A为C元素,由A、B、C、D 的原子序数依次增大,B、C、D位于同一周期,应为第三周期元素,B为Mg元素, C为S元素,则D应为Cl元素。
A. A为C元素,对应的最高价氧化物的水化物为碳酸,属于弱酸,C为S元素,对应的最高价氧化物的水化物为硫酸,属于强酸,故酸性:C> A ,A错误;
B. 元素B为Mg元素,A 的最高价氧化物是CO2,根据反应:2Mg+CO2![]() 2MgO+C,该反应为置换反应,B正确;
2MgO+C,该反应为置换反应,B正确;
C. AC2形成的化合物为CS2,硫原子最外层6个电子,接受两个电子稳定,碳原子最外层4个电子,中心原则碳原子孤电子对数为:![]() ,则碳原子的价层电子对数为2,则CS2的空间构型为直线型,C错误;
,则碳原子的价层电子对数为2,则CS2的空间构型为直线型,C错误;
D. C2D2形成的化合物为S2Cl2 ,是共价化合物,氯原子最外层7个电子,接受1个电子稳定,硫原子最外层6个电子,中间硫与硫之间形成一对电子,中心原子硫原子孤电子对数为:![]() ,则硫原子的价层电子对数为2+2=4,所以VSEPR模型为四面体,则分子结构为:
,则硫原子的价层电子对数为2+2=4,所以VSEPR模型为四面体,则分子结构为: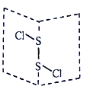 ,结构中正负电荷中心不重合,是极性分子,D错误。
,结构中正负电荷中心不重合,是极性分子,D错误。
答案选B。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】弱电解质有许多如:醋酸、碳酸、氢氰酸、一水合氨等,已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表
氢氰酸 | 碳酸 | 醋酸 |
Ka=6.2×10-10 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为____(填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_________。
(3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,则混合溶液中c(H+) _____c(OH-)(用 < > = 填空)
(4)常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
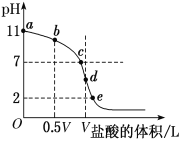
①该温度时NH3·H2O的电离常数K=______。
②比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为________。
③滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是________(填字母,下同)。
A.c(H+)·c(OH-) B. ![]()
C.  D.
D. ![]()
④根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH![]() 和NH3·H2O两种形式)。
和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内,ν(Q)=0.075mol·L-1·min-1,ν(Z)∶ν(Y)=1∶2。
(1)方程式中m=______,n=______,p=______,q=______。
(2)2.5min内,Q的转化率为______________。
(3)对于该反应,能增大正反应速率的措施是___________
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度
(4)该反应达到化学平衡状态时___________
A.容器内气体压强保持不变 B.容器内气体密度保持不变
C.容器内气体平均摩尔质量保持不变 D.正反应速率与逆反应速率相等