��Ŀ����
����Ŀ��ij�¶��£����ݻ�Ϊ2L�ĺ����ܱ������У�����8 mol A��4 mol B�������·�Ӧ��3A(g)+2B(g) ![]() 4C(s)+D(g)��2 min��ƽ�⣬�������3.2mol C������˵����ȷ����
4C(s)+D(g)��2 min��ƽ�⣬�������3.2mol C������˵����ȷ����
A.ǰ2 min��D��ƽ����Ӧ����Ϊ0.4 mol��L��1��min��1
B.B��ƽ��ת������40��
C.�����������䣬�������ϵ��ѹǿ��ƽ�ⲻ�ƶ�
D.�����������䣬��ƽ����ϵ�г���B��ƽ�������ƶ���B��ƽ��ת��������
���𰸡�B
��������
2L���ܱ������У�����8molA��4molB�������·�Ӧ��3A(g)+2B(g)4C(s)+2D(g)����Ӧһ��ʱ���ﵽƽ�⣬�������3.2mol C����
3A(g)+2B(g)4C(s)+D(g)
��ʼ��mol��8 4 0 0
ת����mol��2.4 1.6 3.2 0.8
ƽ�⣨mol��5.6 2.4 3.2 0.8
A. ����D��=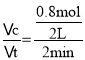 =0.2 molL1min1����A����
=0.2 molL1min1����A����
B. �ﵽƽ�⣬�μӷ�Ӧ��B�����ʵ���Ϊ1.6mol����B��ת����Ϊ![]() ��100%=40%����B��ȷ��
��100%=40%����B��ȷ��
C. �÷�Ӧ����ӦΪ���������С�ķ�Ӧ������ѹǿƽ��������Ӧ�ƶ����������ƶ�����C����
D. ��ƽ����ϵ�г���B ��B��Ũ������ƽ��������Ӧ�ƶ���A��ת��������B��ת���ʽ��ͣ���D����
��ѡB��

����Ŀ����������������磺���ᡢ̼�ᡢ�����ᡢһˮ�ϰ��ȣ���֪25��ʱ�����ᡢ̼�ᡢ������ĵ���ƽ�ⳣ�����±�
������ | ̼�� | ���� |
Ka=6.2��10-10 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=1.7��10-5 |
��1��25��ʱ��pH��ȵ�������Һ��CH3COONa��Һ����Na2CO3��Һ����NaCN��Һ��Ũ���ɴ�С��˳��Ϊ____(�����)��
��2��25��ʱ����NaCN��Һ��ͨ������CO2����Ӧ�����ӷ���ʽΪ_________��
��3����Ũ��Ϊ0.02mol/L��HCN ��0.01mol/LNaOH ��Һ�������ϣ�������Һ��c(H+) _____c(OH-)���� < > = ��գ�
��4�������£���Ũ��Ϊ0.1 mol��L��1�����ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ���Һ��pH������ļ����������͵ĵζ����ߣ�d��������Һǡ����ȫ��Ӧ������ͼ����Ϣ�ش��������⣺
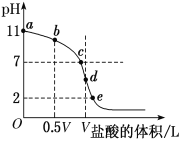
�ٸ��¶�ʱNH3��H2O�ĵ��볣��K��______��
�ڱȽ�b��c��d����ʱ����Һ�У���ˮ�������c(H��)�ɴ�С˳��Ϊ________��
�۵ζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ���ֲ������________(����ĸ����ͬ)��
A��c(H��)��c(OH-) B. ![]()
C.  D.
D. ![]()
�ܸ������ϵζ������ж�����˵����ȷ����________(��Һ��NԪ��ֻ����NH![]() ��NH3��H2O������ʽ)��
��NH3��H2O������ʽ)��
A����b��ʾ��Һ�У�c(NH![]() )��c(H��)��c(OH��)��c(NH3��H2O)
)��c(H��)��c(OH��)��c(NH3��H2O)
B����c��ʾ��Һ�У�c(Cl��)��c(NH3��H2O)��c(NH![]() )
)
C����d��ʾ��Һ�У�c(Cl��)>c(H��)>c(NH![]() )>c(OH��)
)>c(OH��)
D���ζ������п����У�c(NH3��H2O)>c(NH![]() )>c(OH��)>c(Cl��)>c(H��)
)>c(OH��)>c(Cl��)>c(H��)