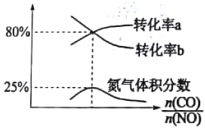
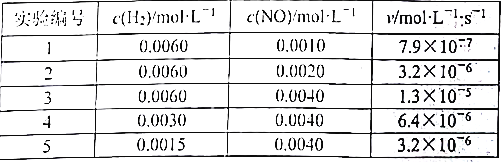
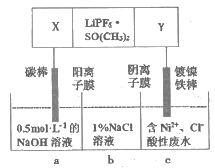
题目内容
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
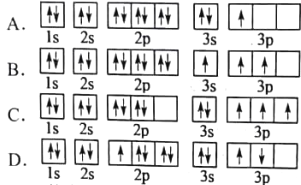
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
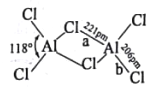
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
【答案】A 发射 洪特规则 < 共价键的键长越短,键能越大 sp3 平面三角形 Na3AIF6 12 ![]()
【解析】
本题主要考查电子排布式特点、原子的杂化方式、分子空间构型的分析、以晶胞为单位的密度计算等知识点。
(1)根据能量最低原理,核外电子先占据能量低的原子轨道,原子轨道的能量由低到高的顺序为1s<2s<2p<3s<3p。根据电子排布的特点,只有A符合能量最低原理;电子由高能级向低能级转变时产生的光谱是发射光谱;洪特规则是指当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。状态D不符合这一规则。
(2)①因为共价键的键长越短,键能越大,b键的键长较大,所以a键的键能小于b键的键能;
②Al2Cl6中每个铝原子和四个氯原子形成4个共价键,采取sp3杂化;AlCl3中Al只形成三个共价键,中心原子Al是sp2杂化,三氯化铝的分子构型为平面三角形结构;
(3)①由化合价代数和为0可知,冰晶石的化学式为Na3AIF6;AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置,因为一个NaCl晶胞中含有4个Cl-,故一个冰晶石的晶胞中含有4个AlF63-,故一个晶胞中含有12个Na+;
②一个冰晶石的晶胞中含有4个Na3AIF6,Na3AIF6的分子量为210,由![]() 得
得![]()
![]() pm。
pm。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案