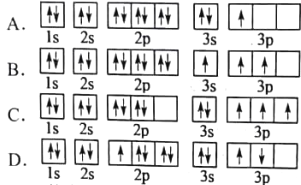
题目内容
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法错误的是
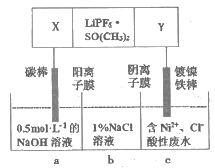
A. 电极Y应为Li
B. X极反应式为FeS+2Li++2e-=Fe+Li2S
C. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
【答案】C
【解析】
本题主要考查原电池与电解池串联问题。通过总反应可知,Li发生氧化反应,作负极,FeS发生还原反应,作正极;因c中由Ni2+生成单质Ni,即发生还原反应,故Y极为负极,X为正极。
A.由上述分析可知,Y为原电池负极,故Y为Li,选项A正确;
B.X极为正极,FeS发生还原反应,故电极反应式为: FeS+2Li+ +2e- =Fe+Li2S,选项B正确;
C.电解过程中,a为阳极区,发生氧化反应: 4OH--4e- =2H2O+O2↑, a中Na+通过阳离子交换膜进入b中;C中发生还原反应: Ni2+ +2e-=Ni,溶液中Cl-通过阴离子交换膜进入b中。故电解过程中, b中NaCl的物质的量浓度将不断增大,选项C错误;
D.若将阳离子交换膜去掉,因b中含有C1-,故阳极电极反应式为: 2C1--2e-=Cl2↑,故电解反应总方程式发生改变,选项D正确;
答案选C。

练习册系列答案
相关题目