题目内容
【题目】氮的氧化物参与雾霾的形成,利用CO和H2在一定条件下可将NO转化为无害物质。回答下列问题:
(1)汽车气缸中发生复杂的化学反应,其中有如下三个重要反应:
反应1:N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJ/mol
2NO(g) △H=+180.5kJ/mol
反应2:2CO(g)![]() 2C(s)+O2(g) △H=+221 kJ/mol
2C(s)+O2(g) △H=+221 kJ/mol
反应3:C(s)+O2(g)![]() CO2(g) △H=-393.5 kJ/mol
CO2(g) △H=-393.5 kJ/mol
①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的△H=___________。
N2(g)+2CO2(g)的△H=___________。
②下列有关反应1的说法中正确的是___________。
A.反应物的总键能小于生成物的总键能
B.正反应的活化能大于逆反应的活化能
C.使用催化剂可使反应1的反应热减小
D.其它条件不变,加压,正逆反应速率不变,平衡不移动
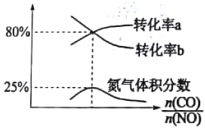
③定温定容条件下,向容积为1L的密闭容器中充入一定量的NO和CO的混合气体(总物质的量保持4mol),平衡时NO、CO的转化率及N2的体积分数与![]() 的关系如图所示,CO转化率对应的曲线为___________(填“转化率a”或“转化率b”,氮气体积分数25%时该反应的平衡常数K=___________,初始时n(NO)=___________.
的关系如图所示,CO转化率对应的曲线为___________(填“转化率a”或“转化率b”,氮气体积分数25%时该反应的平衡常数K=___________,初始时n(NO)=___________.
(2)1073K时,H2与NO可发生反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g),该反应的正反应速率方程为:v=kca(H2)×cb(NO)(a、b分别为H2和NO的级数,k为速率常数)。
N2(g)+2H2O(g),该反应的正反应速率方程为:v=kca(H2)×cb(NO)(a、b分别为H2和NO的级数,k为速率常数)。
在定容容器中,分别充入不同浓度的NO和H2,测得该反应的正反应速率如下表所示:
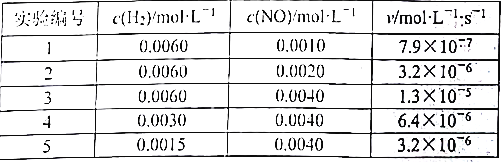
利用上表数据可确定a=___________(保留整数),b=___________(保留整数),k=___________(保留两位有效数字)。
【答案】-746.5kJ/mol B 转化率b 80L/mol 2mol 1 2 ![]()
【解析】
本题主要考查盖斯定律的计算、对方热概念的理解,可从三段式计算和平衡常数计算角度入手。
(1)①由盖斯定律,2×反应3+反应2-反应1可得目标反应式2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的△H=-393.5×2+221-180.5=-746.5kJ/mol;
N2(g)+2CO2(g)的△H=-393.5×2+221-180.5=-746.5kJ/mol;
②反应1正向为吸热反应,反应物的总键能大于生成物的总键能,A项错误;反应热等于正反应的活化能与逆反应的活化能之差,△H>0,正反应的活化能大于逆反应的活化能,B项正确;催化剂不改变反应热,C项错误;加压,正逆反应速率变大,D项错误;
③随着![]() 增大,即CO含量增大时,NO转化率必然增大,所以CO对应转化率b的曲线。
增大,即CO含量增大时,NO转化率必然增大,所以CO对应转化率b的曲线。
由三段式计算,设初始时n(NO)=a mol,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol): a 4-a 0 0
变化量(mol): 0.8a 0.8a 0.4a 0.8a
平衡量(mol): 0.2a 4-1.8a 0.4a 0.8a
由图中信息可知,氮气体积分数为25%时,NO和CO转化率均为80%,所以80%=0.8a/(4-a),解出a=2。因为容器的体积为1L,故平衡常数![]() L/mol。
L/mol。
故本题答案为:-746.5kJ/mol;B;转化率b;80L/mol;2mol
(2)由第3、4、5组数据可看出c(H2)与v成正比关系,故a=1;由第1、2、3组数据可看出c2(NO)与v成正比,故b=2;将5组数据带入后求出k平均值为![]() 。
。