题目内容
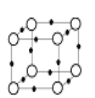
【题目】工业用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,研究小组用如图装置模拟该过程,并通过测定反应后溶液中SO32-的浓度来计算该反应的转化率。

实验步骤
①按图连接好装置,检查气密性;
②取200mL0.5000mol/L的(NH4)2SO3溶液(含有一定量氨水,pH=8)装入三颈烧瓶中,加入催化剂,控制气体流速为300L/h,控制温度在50℃进行实验;
③反应2.5小时后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器a的名称是____________________________________________。
(2)装置B的作用是_______________________________________________________。
(3)C中(NH4)2SO3被氧化,该反应的离子方程式为______________________;装置C中的反应需要控制溫度在50℃,采用的实验措施是______________________;C中溶液的pH不能低于8,原因是____________________________________________。
(4)取20.00mL反应后的溶液于碘量瓶中,滴入3滴淀粉溶液,用0.1000mol/L的标准碘溶液滴定至终点,消耗碘水体积为18.50mL,则(NH4)2SO3的转化率为_____________________。
(5)指出实验装置存在的缺陷_________________________________(写一条)
【答案】锥形瓶 提供饱和水蒸气,避免气体带走C中水蒸气使溶液体积减小,导致转化率的计算不准确 2SO32-+O2=2SO42- 用水浴加热 防止生成SO2逸出 81.5% 没有吸收NH3的装置、没有温度计、没有加热装置(写一条即可)
【解析】
(1)由图可知仪器a的名称是锥形瓶;
(2)装置B的作用是提供饱和水蒸气,避免气体带走C中水蒸气使溶液体积减小,导致转化率的计算不准确;
(3)C中(NH4)2SO3被氧化成(NH4)2SO4;要使受热均匀,控制温度在50℃,采用的实验措施是用水浴加热;酸性强,易生成SO2。
(4)根据反应方程式SO32-+I2+H2O═SO42-+2I-+2H+计算;
(5)实验装置存在的缺陷:没有吸收NH3的装置、没有温度计、没有加热装置等。
(1)由图可知仪器a的名称是锥形瓶;
(2)装置B的作用是提供饱和水蒸气,避免气体带走C中水蒸气使溶液体积减小,导致转化率的计算不准确;
(3)C中(NH4)2SO3被氧化成(NH4)2SO4,该反应的离子方程式为2SO32-+O2=2SO42-;要使受热均匀,装置C中的反应需要控制温度在50℃,采用的实验措施是用水浴加热;酸性强,易生成SO2,C中溶液的pH不能低于8,原因是防止生成SO2逸出;
(4)根据反应方程式SO32-+I2+H2O═SO42-+2I-+2H+可知,n(SO32-)=n(I2)=0.1000mol/L×18.50×10-3L,则(NH4)2SO3的转化率为=1-![]() =0.815,即81.5%。
=0.815,即81.5%。
(5)根据实验原理可知,该实验装置存在的缺陷:没有吸收NH3的装置、没有温度计、没有加热装置(写一条即可)。

【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。