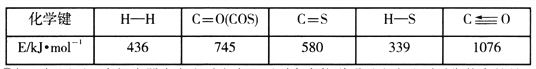
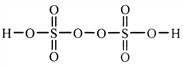
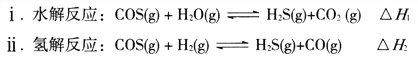题目内容
【题目】等体积NaCl,MgCl2,AlCl3三种溶液分别于等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl,MgCl2,AlCl3三种溶液的物质的量浓度之比为( )
A.1:2:3B.3:2:1C.6:3:2D.1:1:1
【答案】C
【解析】
设NaC1、MgCl2、A1Cl3的物质的量分别为x、y、z,分别加入等量的AgNO3溶液,恰好都完全反应,说明三种溶液中Cl-的物质的量相等,x=y×2=z×3,解得x:y:z=6:3:2,因溶液的体积相同,则物质的量之比等于浓度之比,所以浓度之比为6:3:2,故答案为C。

【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
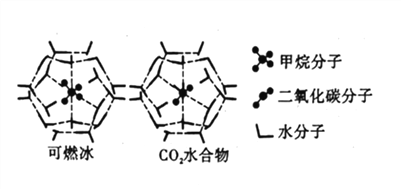
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
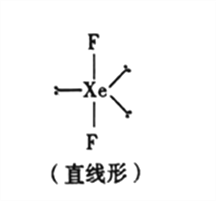
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。