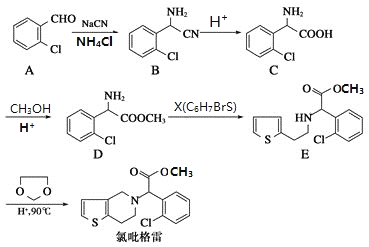
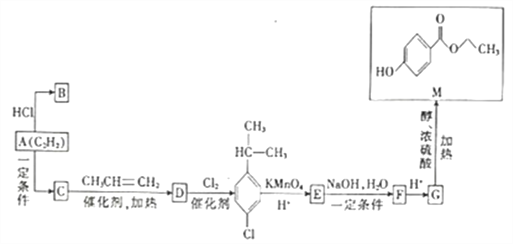
题目内容
【题目】某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H =-273kL/mol
②NO2-(aq)+l/2O2(g)=NO3-(aq) △H =-73kL/mol
下列叙述不正确的是
A. lmol的NH3和1mol的NH4+都有10×6.02×1023个电子
B. 室温下,0.1mol/LHNO2(aq) pH>l,则NaNO2溶液显碱性
C. NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H =-346kL/mol
D. 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
【答案】D
【解析】A.1mol的NH3和1mol 的NH4+都有10个电子,即10×6.02×1023个电子,故A正确;B.0.1 mol/L HNO2(aq) pH>1,说明溶液中存在电离平衡,HNO2是弱酸,NaNO2溶液水解显碱性,故B正确;C.①NH4+(aq)+ ![]() O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kL/mol、②NO2-(aq)+
O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kL/mol、②NO2-(aq)+ ![]() O2(g)=NO3-(aq)△H=-73kL/mol,依据盖斯定律①+②得到NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol,故C正确;D.在上述两次转化过程中,氢离子浓度增大,废水的酸性增大,故D错误;故选D。
O2(g)=NO3-(aq)△H=-73kL/mol,依据盖斯定律①+②得到NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol,故C正确;D.在上述两次转化过程中,氢离子浓度增大,废水的酸性增大,故D错误;故选D。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)写出溶液④中通少量CO2的离子方程式:_________________________.
(2)25℃时,溶液①中,由水电离产生的c(OH﹣)=_____molL﹣1。
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=____________.(用ab表示)