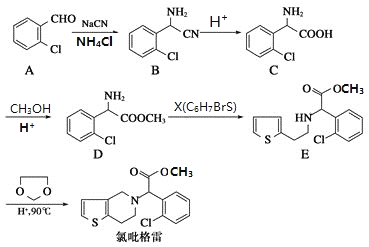
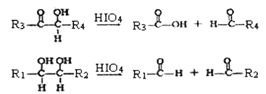
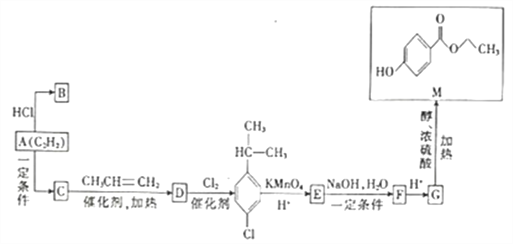
题目内容
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式__________________________________________。
(2)比较下列溶液中指定微粒浓度的大小:浓度均为0.1 mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是_____________。(填序号)c(H2S)从大到小的顺序是__________。(填序号)
(3)已知Ksp[Cu(OH)2] = 1×10-20 。要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为_________________。
【答案】 Si(s)+2Cl2(g)===SiCl4(l) ΔH=-687 kJ/mol ③>②>④>① ④>①>②>③ pH > 6.5
【解析】本题主要考查化学反应原理的综合习题。
(1)硅和氯两元素的形成的Si的最高价化合物是四氯化硅,由四氯化硅的熔、沸点可知室温下四氯化硅呈液态,该反应的热化学方程式:Si(s)+2Cl2(g)===SiCl4(l) ΔH=-687 kJ/mol。
(2)比较下列溶液中指定微粒浓度的大小:浓度均为0.1 mol·L-1的①H2S少量电离产生H+,H2S![]() HS-+H+,②NaHS水解使溶液呈碱性,HS-+H2O
HS-+H+,②NaHS水解使溶液呈碱性,HS-+H2O![]() H2S+OH-,③Na2S水解使溶液呈碱性,且水解程度大于NaHS,S2-+H2O
H2S+OH-,③Na2S水解使溶液呈碱性,且水解程度大于NaHS,S2-+H2O![]() HS-+OH-,④NaHS抑制H2S电离,,溶液pH从大到小的顺序是③>②>④>① 。c(H2S)从大到小的顺序是④>①>②>③。
HS-+OH-,④NaHS抑制H2S电离,,溶液pH从大到小的顺序是③>②>④>① 。c(H2S)从大到小的顺序是④>①>②>③。
(3)要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全时,c(Cu2+)<10-5mol/L,c(OH-)>( 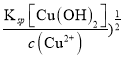 =10-7.5mol/L,c(H+)=
=10-7.5mol/L,c(H+)= 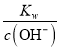 <
<![]() mol/L =1×10-6.5mol/,调整溶液的pH范围为pH > 6.5。
mol/L =1×10-6.5mol/,调整溶液的pH范围为pH > 6.5。

【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为____________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=________,k=________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:反应开始到10 min时Cl2的平均反应速率v(Cl2)=________ mol·L-1·min-1。
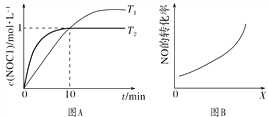
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[温度、压强、![]() 、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.100molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.100 | 22.18 | 20.00 |
2 | 0.100 | 22.22 | 20.00 |
3 | 0.100 | 22.20 | 20.00 |
①该实验滴定达到终点的标志是_____________________________。
②根据上述数据,可计算出该盐酸的浓度约为_________________(保留三位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
④现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的指示剂为_______。