题目内容
【题目】用 CO2 生产绿色燃料甲醇时发生反应 A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
(1)2CH3OH(g) + 3O2 (g)=2CO2(g) +4H2O(g) △H= -1365.0kJ/mol
H2(g)+![]() O2 (g) =H2O(g) △H= -241.8 kJ/mol
O2 (g) =H2O(g) △H= -241.8 kJ/mol
CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应热△H=_________。(写出计算过程)
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol 和 1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。
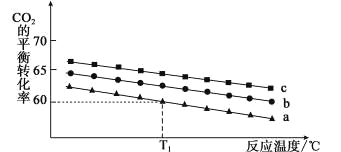
①曲线c对应的投料是_____。
②T1℃时,曲线a对应的化学平衡常数是_____。(写出计算过程,计算结果保留小数点后两位)。
③500℃时,反应A 的平衡常数K=2.5,T1℃_____500℃(填“高于”、“低于”或“等于”)。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下:
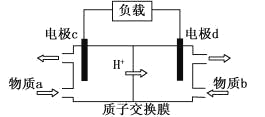
①d电极上发生的是_____(填“氧化”或“还原”)反应。
②物质b是_____(填化学式)。
③写出c电极的电极反应式_____。
【答案】-42.9kJ/mol n(CO2)=1mol,n(H2)=6mol 0.52 高于 还原 H2O2 CH3OH-6e-+H2O=CO2+6H+
【解析】
根据盖斯定律:②×3-![]() ×①得到焓变的值;当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,根据相同温度下的转化率数值确定曲线;根据a曲线的转化率和“三段式”计算平衡常数;反应为放热反应,升高温度平衡逆向移动,平衡常数减小,判断温度;根据氢离子的移动方向确定正负极,并写出电极反应。
×①得到焓变的值;当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,根据相同温度下的转化率数值确定曲线;根据a曲线的转化率和“三段式”计算平衡常数;反应为放热反应,升高温度平衡逆向移动,平衡常数减小,判断温度;根据氢离子的移动方向确定正负极,并写出电极反应。
(1)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H= -1365.0kJ/mol
H2(g)+![]() O2(g)=H2O(g) △H= -241.8 kJ/mol
O2(g)=H2O(g) △H= -241.8 kJ/mol
根据盖斯定律:②×3-![]() ×①得:
×①得:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-42.9kJ/mol;
(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol;
②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,列出反应的“三段式”
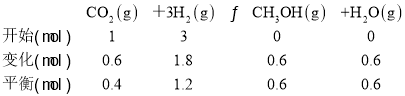
容器的体积为1L,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)=1.2mol/L,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,K=![]() =0.52,T1℃时,曲线a对应的化学平衡常数是0.52;
=0.52,T1℃时,曲线a对应的化学平衡常数是0.52;
③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。
(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;
②物质b在d电极上发生还原反应,物质b是H2O2;
③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH-6e-+ H2O=CO2+6H+。

 阅读快车系列答案
阅读快车系列答案