题目内容
【题目】下列有关叙述中正确的是( )
A.常温下,![]() 的
的![]() 与
与![]() 混合溶液中:
混合溶液中:![]()
B.NaCl溶液和![]() 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C.相同温度下,若![]() ,则AgCl的溶解度大于
,则AgCl的溶解度大于![]()
D.醋酸溶液加少量水稀释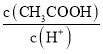 增大
增大
【答案】A
【解析】
A.常温下,![]() 的
的![]() 与
与![]() 混合溶液呈酸性,则
混合溶液呈酸性,则![]() ,根据电荷守恒可知:
,根据电荷守恒可知:![]() ,故A正确;
,故A正确;
B.NaCl溶液和![]() 溶液均显中性,氯化钠对水的电离无影响,而醋酸根离子、铵根离子发生水解,促进了水的电离,两溶液中水的电离程度不相同,故B错误;
溶液均显中性,氯化钠对水的电离无影响,而醋酸根离子、铵根离子发生水解,促进了水的电离,两溶液中水的电离程度不相同,故B错误;
C.AgCl、Ag2CrO4的化学式类型不同,不能直接利用溶度积判断溶解度大小,故C错误;
D.醋酸中加入少量水后,醋酸的电离程度增大,则溶液中醋酸根离子浓度减小,电离平衡常数不变,则![]() =
=![]() 的比值减小,故D错误;
的比值减小,故D错误;
故选A。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
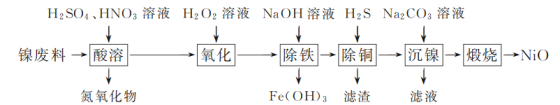
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。