题目内容
10.某种胃药中止酸剂为CaCO3.为测定其中CaCO3含量,某研究小组设计以下(药片中的其它成分与HCl和NaOH溶液均不反应),用滴定法测定,有以下几步操作:A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂,用0.100mol/L NaOH溶液滴定,用去体积为VmL达
到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
回答下列问题;
(1)测定过程的正确操作顺序为ABDC 或BADC(填字母).
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数60%.
分析 (1)配制标准溶液,把药品研磨溶解,向药片溶液中加HCl与碳酸钙反应,然后用氢氧化钠滴定多余的HCl,由于A、B是并列操作,不存在先后问题;
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑计算碳酸钙的质量,再根据质量分数定义计算.
解答 解:(1)配制标准溶液,把药品研磨溶解,向药片溶液中加HCl与碳酸钙反应,然后用氢氧化钠滴定多余的HCl,由于A、B是并列操作,不存在先后问题,故测定过程的正确操作顺序为ABDC 或BADC,
故答案为:ABDC 或BADC;
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.
根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑可知,100g:2mol=m(CaCO3):0.100 mol/L×0.012L,解得:m=0.06 g,
碳酸钙的质量分数为$\frac{0.06g}{0.1g}$×100%=60%,
故答案为:60%.
点评 本题以滴定原理考查物质含量测定,难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
9.10mL 3种气态烃的混合物和足量氧气混合点燃爆炸后恢复到原来状态(常温常压),气体体积共缩小了20mL(不考虑CO2的溶解).则这3种烃可能的组合是( )
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
1.某小组通过实验研究Na2O2与水的反应.
(1)Na2O2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应.
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.00mL溶液a,用稀H2SO4酸化,逐滴加入
0.003mol•L-1 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mL KMnO4溶液.
①请配平:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
②溶液a中c(H2O2)=0.01mol•L-1.
③溶液褪色速率开始较慢后变快的原因可能是反应生成的Mn2+作催化剂.
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol•L-1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色.
Ⅳ.向0.1mol•L-1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化.
①从实验Ⅲ和Ⅳ中,可得出的结论是碱性条件下,H2O2能与酚酞反应而O2不能.
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应.实验方案是:取少量溶液a于试管中,加入MnO2,充分反应后,向上层清液中滴入2滴酚酞后变红,10分钟后,溶液颜色无明显变化.
| 操作 | 现象 |
| 向盛有4g Na2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应.
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.00mL溶液a,用稀H2SO4酸化,逐滴加入
0.003mol•L-1 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mL KMnO4溶液.
①请配平:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
②溶液a中c(H2O2)=0.01mol•L-1.
③溶液褪色速率开始较慢后变快的原因可能是反应生成的Mn2+作催化剂.
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol•L-1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色.
Ⅳ.向0.1mol•L-1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化.
①从实验Ⅲ和Ⅳ中,可得出的结论是碱性条件下,H2O2能与酚酞反应而O2不能.
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应.实验方案是:取少量溶液a于试管中,加入MnO2,充分反应后,向上层清液中滴入2滴酚酞后变红,10分钟后,溶液颜色无明显变化.
15.下列表示的是N原子的轨道表示式: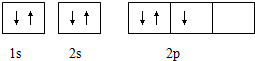 它违背了( )
它违背了( )
 它违背了( )
它违背了( )| A. | 能量守恒原理 | B. | 能量最低原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
2.将纯锌片和纯铜片用导线连接后放入稀硫酸中发生原电池反应,下列叙述正确的是( )
| A. | 正极有O2逸出 | B. | 负极附近的SO42-浓度逐渐增大 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片表面发生氧化反应 |
19.下列各组物质互为同系物的是( )
| A. | O2,O3 | B. | ${\;}_{6}^{13}$C,${\;}_{6}^{12}$C | C. | 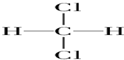 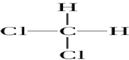 | D. | CH3CH3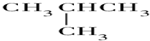 |
20.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |