题目内容
18.写出下列化学反应方程式:(1)将SO2气体通入溴水中:SO2+Br2+2H2O=H2SO4+2HBr
(2)碳和浓硫酸反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O
(3)氨气的催化氧化:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)二氧化硫与溴水发生氧化还原反应生成硫酸和溴化氢;
(2)浓硫酸具有强的氧化性,与碳发生反应生成二氧化碳、二氧化硫和水;
(3)氨气具有还原性,氧气具有氧化性,氨气中氮元素为-3价,被氧气氧化为+2价的氮元素,所以氨气和氧气反应生成一氧化氮和水.
解答 解:(1)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应生成硫酸和HBr,溶液中溴的颜色会褪去,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
(2)碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(3)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了化学方程式和离子方程式的书写,题目难度中等,明确化学反应的实质是解题的关键,注意掌握化学方程式的书写原则,试题侧重考查学生灵活应用基础知识的能力.

练习册系列答案
相关题目
17.设NA为阿伏加德罗常数的值.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
9.硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:
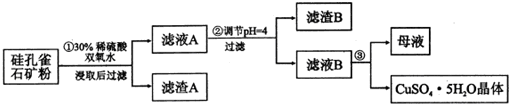
(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
则滤液B中含有的阳离子是Al3+、Cu2+、H+.
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:

(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
6.室温下,向a mol/L氨水中逐滴加入盐酸,下列描述不正确的是( )
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
13.1993年的世界十大科技新闻称:中国学者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成.关于此物质,下列说法错误的是( )
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 易被氧化 |
3.下列反应的离子方程式表示不正确的是( )
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
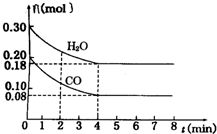 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g) 和
和
 和
和
