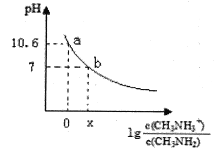
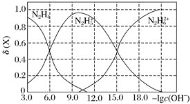
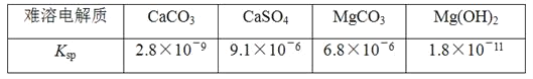
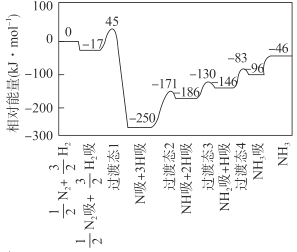
题目内容
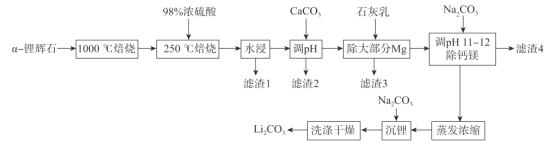
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以![]() -锂辉石为原料制备碳酸锂,其工艺流程如下:
-锂辉石为原料制备碳酸锂,其工艺流程如下:
已知:①![]() -锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,
-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, ![]() -锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
-锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
②β一锂辉石可与浓硫酸发生反应:2β一LiAl(SiO3)2+ H2SO4(浓)![]() Li2SO4 +Al2O3·4SiO2·H2O。
Li2SO4 +Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为_______,1000 °C焙烧![]() -锂辉石的目的为_____.
-锂辉石的目的为_____.
(2)滤渣2的主要成分为________调节pH值的范围为________。
(3)“除大部分Mg”步骤的离子方程式为______________。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、______________。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为________________________________。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiM1.5Ni0.5O4作为正极材料,以可传导Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-x Mn0.5Ni0.5O4 + Lix(CoP3 )![]() LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
【答案】Li2O·Al2O3·4SiO2 将不与浓硫酸反应的α-锂辉石转化成为能与浓硫酸反应的β一锂辉石 Fe(OH)3、Al(OH)3、CaSO4 4.7≤pH<9.6 Ca(OH)2(s)+Mg2+(aq)=Mg(OH)2(s)+Ca2+(aq) 蒸发皿和玻璃棒 取少量最后一次洗涤液于试管中,先加入HCl,再加入BaCl2溶液,若无白色沉淀生成,则证明沉淀洗涤干净 Lix(CoP3)-xe-=xLi++(CoP3) LiMn1.5Ni0.5O4-xe-=Li1-xMn0.5Ni0.5O4+xLi+
【解析】
根据信息①α-锂辉石几乎不与任何酸碱反应,α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性,1000℃的焙烧的目的是α-锂辉石→β-锂辉石,根据信息②250℃时β-锂辉石与硫酸发生反应,根据锂辉石含有物质,以及信息②,SiO2为酸性氧化物,不与硫酸发生反应,即水浸时得到滤渣1为SiO2,滤液中有Li+、Fe3+、Mg2+、Al3+,根据流程,调pH的目的是除去Fe3+、Al3+,“除去大部分Mg”将Mg2+转化成Mg(OH)2,“除钙镁”的目的是将多余Ca2+以CaCO3形式除去,据此分析;
(1)硅酸盐改写成氧化物的形式活泼金属氧化物·较活泼金属氧化物·SiO2·H2O,各元素的原子比例不能改变,即LiAl(SiO3)2改写成氧化物的形式:Li2O·Al2O3·4SiO2;根据信息①:α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, α-锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性,因此1000℃焙烧的目的是将不与浓硫酸反应的α-锂辉石转化成为能与浓硫酸反应的β一锂辉石;
(2)根据流程以及原料中含有成分,得出加入碳酸钙调pH的目的是将Fe3+、Al3+转化成Fe(OH)3和Al(OH)3,碳酸钙与硫酸反应会生成微溶的硫酸钙,滤渣2的主要成分是Fe(OH)3、Al(OH)3,含有少量的CaCO3和CaSO4;滤渣2主要成分氢氧化铁和氢氧化铝,因此需要调节pH应≥4.7,调pH,没有使Mg2+沉淀出来,因此pH应小于3.7,即pH的范围是4.7≤pH<9.6;
(3)氢氧化镁为难溶物,氢氧化钙为微溶物,利用反应向着更难溶的方向进行,其离子方程式为Ca(OH)2(s)+Mg2+(aq)=Mg(OH)2(s)+Ca2+(aq);
(4)蒸发浓缩需要的仪器有酒精灯、铁架台(带铁圈)、蒸发皿和玻璃棒,因此除酒精灯、铁架台(带铁圈)外,还需要蒸发皿和玻璃棒;
(5)“沉锂”发生Li2SO4+Na2CO3=Li2CO3↓+Na2SO4,Li2CO3表面杂质含有Na2CO3和Na2SO4,因此检验沉淀是否洗涤干净的操作是取少量最后一次洗涤液于试管中,先加入HCl,再加入BaCl2溶液,若无白色沉淀生成,则证明沉淀洗涤干净;
(6)根据原电池工作原理,负极上发生氧化反应,化合价升高,依据题意,负极上的反应式为Lix(CoP3)-xe-=xLi++(CoP3);充电时,电池的正极连接电源的正极,根据电解原理,阳极上发生氧化反应,即阳极电极反应式为LiMn1.5Ni0.5O4-xe-=Li1-xMn0.5Ni0.5O4+xLi+。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】I.氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。请回答下列问题:
(1)亚硝酰氯(结构式为![]() )是有机合成中的重要试剂,它可由
)是有机合成中的重要试剂,它可由![]() 和
和![]() 在常温常压条件下反应制得,反应方程式为:
在常温常压条件下反应制得,反应方程式为:![]() 。已知几种化学键的键能数据如表所示:
。已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能 | 243 | 200 | 607 | 630 |
则![]()
![]() ________
________![]() 。
。
(2)在一个恒容密闭容器中充入![]() 和
和![]() 发生(1)中的反应,在温度分别为
发生(1)中的反应,在温度分别为![]() ℃、
℃、![]() ℃时测得
℃时测得![]() 的物质的量(单位:mol)与时间的关系如下表所示:
的物质的量(单位:mol)与时间的关系如下表所示:
t/min 温度 | 0 | 5 | 8 | 13 |
| 2 | 1.5 | 1.3 | 1.0 |
| 2 | 1.15 | 1.0 | 1.0 |
①![]() ________
________![]() (填“
(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
②温度为![]() 时,起始时容器内的压强为
时,起始时容器内的压强为![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() ________(用平衡分压代替平衡浓度计算,分压
________(用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数)(化为最简式)。
物质的量分数)(化为最简式)。
(3)近年来,地下水中的氮污染已成为世界性的环境问题。在金属![]() 、
、![]() 和依(
和依(![]() )的催化作用下,
)的催化作用下,![]() 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮(![]() ),其工作原理如图所示。
),其工作原理如图所示。
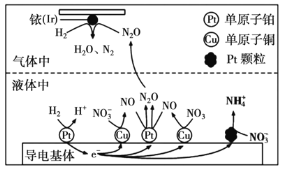
①![]() 表面发生反应的化学方程式为:________。
表面发生反应的化学方程式为:________。
②若导电基体上的![]() 颗粒增多,造成的后果是________。
颗粒增多,造成的后果是________。
Ⅱ.利用电化学原理,将![]() 、
、![]() 和熔融
和熔融![]() 制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
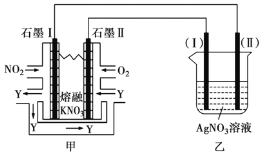
(4)①甲池工作时,![]() 转变成绿色硝化剂
转变成绿色硝化剂![]() ,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
②若用10A的电流电解50min后,乙中阴极得到![]() ,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为
,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为![]() )
)