题目内容
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
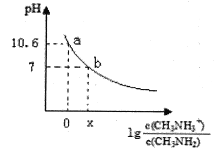
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
【答案】C
【解析】
A. 若加入20mL的盐酸,则盐酸和甲胺恰好完全反应生成CH3NH3Cl溶液,CH3NH3Cl是强酸弱碱盐,所得溶液呈酸性,b点溶液呈中性,所以b点对应加入盐酸的体积小于20mL,故A正确;
B.由甲胺的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-可知,甲胺的电离常数为Kb=c(OH-)c(CH3NH3+)/c(CH3NH2),a点溶液的pH=10.6,c(H+)=10-10.6,c(OH-)=10-3.4,lgc(CH3NH3+)/c(CH3NH2)=0,
CH3NH3++OH-可知,甲胺的电离常数为Kb=c(OH-)c(CH3NH3+)/c(CH3NH2),a点溶液的pH=10.6,c(H+)=10-10.6,c(OH-)=10-3.4,lgc(CH3NH3+)/c(CH3NH2)=0,
则c(CH3NH3+)/c(CH3NH2)=1,代入Kb=c(OH-)c(CH3NH3+)/c(CH3NH2)中,得出Kb=10-3.4,故B正确;
C. b点pH=7,中性溶液,c(H+)=c(OH-),故C错误;
D. 若加入20mL的盐酸,则盐酸和甲胺恰好完全反应生成CH3NH3Cl溶液,CH3NH3Cl是强酸弱碱盐,所得溶液呈酸性,CH3NH3+水解促进水的电离,常温下KW=1×10-14,故溶液中水电离的c(H+)>10-7mol/L,故D正确;
故选C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以![]() -锂辉石为原料制备碳酸锂,其工艺流程如下:
-锂辉石为原料制备碳酸锂,其工艺流程如下:
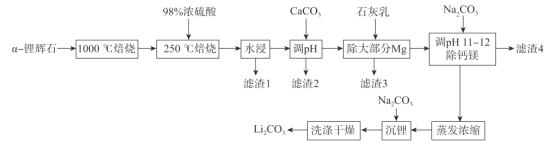
已知:①![]() -锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,
-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, ![]() -锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
-锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
②β一锂辉石可与浓硫酸发生反应:2β一LiAl(SiO3)2+ H2SO4(浓)![]() Li2SO4 +Al2O3·4SiO2·H2O。
Li2SO4 +Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为_______,1000 °C焙烧![]() -锂辉石的目的为_____.
-锂辉石的目的为_____.
(2)滤渣2的主要成分为________调节pH值的范围为________。
(3)“除大部分Mg”步骤的离子方程式为______________。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、______________。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为________________________________。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiM1.5Ni0.5O4作为正极材料,以可传导Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-x Mn0.5Ni0.5O4 + Lix(CoP3 )![]() LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。