题目内容
3.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ•mol-1,△S=-145J•mol-1•K-1.下列说法中错误的是( )| A. | 该反应中反应物的总能量高于生成物的总能量 | |
| B. | 该反应常温下不能自发进行,因此需要高温和催化剂 | |
| C. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| D. | 汽车尾气中的这两种气体会与血红蛋白结合而使人中毒 |
分析 A、依据反应是放热反应,结合能量守恒分析判断;
B、依据△H-T△S<0反应自发进行分析判断;
C、温度变化,速率变化,平衡发生移动;
D、依据一氧化氮和一氧化碳气体能结合血红蛋白分析判断.
解答 解:A、此反应是放热反应,反应物的总能量高于生成物的总能量,故A正确;
B、常温下,2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0.△S<0;△H-T△S<0,低温下反应可以自发进行,故B错误;
C、常温下,2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0.△S<0;△H-T△S<0,该反应低温下能自发进行,高温和催化剂只是加快反应的速率,故C正确;
D、NO、CO都可和血红蛋白结合而使人中毒,故D正确;
故选B;
点评 本题考查了反应焓变熵变的分析判断,反应自发进行的判断依据,平衡移动的因素分析判断,题目较简单.

练习册系列答案
相关题目
11.下列有关说法不正确的是( )
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 乙醇、苯酚均能与NaOH溶液发生反应 | |
| C. | 乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生红色沉淀 | |
| D. | 用饱和Na2CO3溶液能区分乙酸乙酯、乙醇和乙酸 |
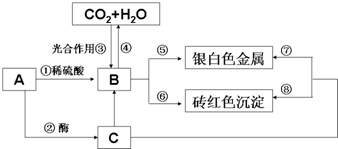
18.由两种元素组成的化合物M有如下转化关系:
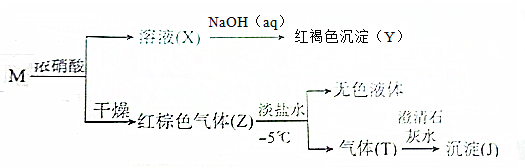
下列推断正确的是( )

下列推断正确的是( )
| A. | M可能是FeS2、Fe3C、CuS、和Fe3O4 | B. | Y可能是Fe(OH)3、Fe2O3 、Cu2O | ||
| C. | X溶液能溶解铁、铜等金属 | D. | 无色液体可能是N2O4和H2O |
15.雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是( )
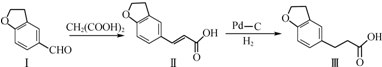

| A. | 与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有9种 | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 化合物Ⅱ中共含有4种官能团 | |
| D. | 可用溴水区分化合物Ⅱ和化合物Ⅲ |
12.汽车上的催化转化器,可将尾气中的主要污染物转化成无毒的物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.6kJ/mol.某温度时,用气体传感器测得不同时间的NO和CO的浓度如下表:
经分析,得出结论不正确的是( )
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4 mol/L) | 10 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3 mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 该反应转化较快,具有现实意义 | |
| B. | 催化转化器在冬季时对废气转化的效率比夏季更高 | |
| C. | 在该温度下,反应的平衡常数K=10000 | |
| D. | 2 s末的平均反应速率为v(NO)=3.75×10-4 mol•L-1•s-1 |
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用,锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )
| A. | 电池工作时,MnO2失去电子 | |
| B. | 电池工作时,电子由锌经外电路流向MnO2 | |
| C. | 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 | |
| D. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) |